化学変化とイオン
ここでは原子が電気を帯びた「イオン」について学習します。
また、身近な物質の中にある酸性、アルカリ性の水溶液や中和についてもこのイオンを通して考えると理解が深まります。
それではこれらについて学習していきましょう。
水溶液とイオン
電解質・非電解質
水の電気分解で学習した通り、純粋な水にはほとんど電流が流れません。電流を流しやすくするために水酸化ナトリウムを溶かしました。
電流を流す水溶液には他にも塩化ナトリウム水溶液や塩酸などがあります。塩化ナトリウムのように、水溶液が電流を流す物質を「電解質」といいます。
一方、砂糖水やエタノール水溶液などは電流を流しません。砂糖のように電流を流さない物質を「非電解質」といいます。
電解質の水溶液で起こる変化
<塩化銅水溶液>
塩化銅水溶液に電流を流すと、以下のような結果が得られます。
- 陰極に赤い物質が付着し、こすると金属光沢が見られる → 金属(銅)
- 陽極からにおいのある気体が発生する → 塩素
つまり、塩化銅水溶液に電流を流すことによって、塩化銅が銅と塩素に分解されたと考えられます。
式に表わすと
となります。また、電極を逆につなぎ変えると、金属の付着や塩素の発生する電極も逆になります。
<塩酸>
塩酸は塩化水素を溶質とする水溶液です。塩酸に電流を流すと以下のような結果が得られます。
- 陰極から発生した気体にマッチの火を近づけると音を立てて燃える → 水素(銅)
- 陽極からにおいのある気体が発生する → 塩素
つまり塩酸に電流を流すことによって、塩化水素が水素と塩素に分解されたと考えられます。
こちらも式に表わすと
となります。
また、先ほどの塩化銅水溶液同様、電極を逆につなぎ変えると、金属の付着や塩素の発生する電極も逆になります。
このように、電解質の水溶液に電流を流すと、陽極、陰極に物質が発生する化学変化が起こります。
このことから、水溶液中にはそれぞれの物質のもととなるもの(粒子)が存在していることが考えられます。
また、陽極、陰極で発生する物質が決まっていることから、粒子によって+、-のどちらの電気を帯びるかが決まっており、それぞれが陽極、陰極へひかれていくと考えられます。
原子の成り立ち
さて、前単元で、全ての物質は原子からできており、原子はそれ以上分解できない粒子であると学習しました。ではこの原子自体はどのような構造になっているのでしょうか。
原子は、原子の中央にある「原子核」と、そのまわりにある「電子」から成り立っています。原子核は+の電気を帯びた「陽子」と、電気を帯びていない「中性子」からできています。
電子は物理分野でも学習した通り、-の電気を帯びています。
陽子と電子は同じ数ずつあり、原子全体で見るとプラスマイナスゼロとなるので、電気を帯びていない状態になります。
イオン
原子は電気を帯びていませんが、電子を失ったり受け取ったりすることによって電気を帯びるようになります。
原子が電子を失って+の電気を帯びたものを「陽イオン」、反対に電子を受け取って-の電気を帯びたものを「陰イオン」といいます。
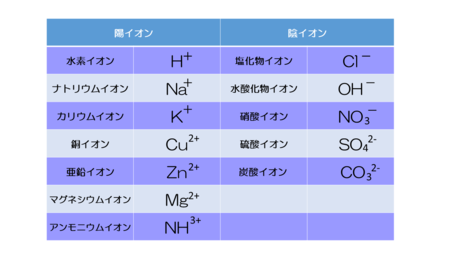
イオンも原子と同じようにアルファベットを使った記号で表されます。この記号を「イオン式」といいます。
基本的には元素記号と同じですが、陽イオンには+を、陰イオンには-を元素記号の右上に小さくつけます。
また、イオンには水酸化物イオンや硝酸イオン、硫酸イオンのように、異なる種類の原子が2個以上集まったものが全体として電気を帯びているものもあります(多原子イオン)。
電離
物質が水に溶けて陽イオンと陰イオンに分かれることを「電離」といいます。塩化ナトリウムや塩化水素などの電解質は電離をします。
電解質の電離は、イオン式を使って次のように表すことができます。
NaCl → Na+ + Cl-
<塩化水素の電離>
HCl → H+ + Cl-
このように電解質の水溶液の中にはイオンが存在するため電流が流れるようになります。一方非電解質は電離しないため水溶液中にイオンが存在せず、電流が流れないのです。
化学変化と電池
電池
電解質の水溶液に2種類の金属板を入れると電流を流すことができます。このように化学変化によって電流を流す仕組みをもつものを「電池」といいます。
電池は大きく化学電池と物理電池に分けられます。
電卓についている電池は、太陽などの光エネルギーを電気エネルギーに変換する物理電池です。これは化学変化を伴いません。
普通「電池」というと乾電池などを想像すると思います。これは化学電池と呼ばれ、化学変化のエネルギーを電気エネルギーに変換する装置です。
化学電池は基本的に陽イオンになりやすい(電子を離しやすい)金属と電子を受け取りやすい物質、そしてそれらを取り巻く電解質からなります。
イオン化傾向
金属によってイオンへのなりやすさには差があります。
金属のイオンへのなりやすさを「イオン化傾向」といいます。
イオン化傾向の大きい(イオンになりやすい)金属を順に並べると以下のようになります。
2種類の金属板を使用して電池を作ったとき、イオン化傾向の大きい方の金属が-極になります。また、2種類の金属のイオン化傾向の差が大きいほど金属管に生じる電圧は大きくなります。
なお、このイオン化傾向の順は中学理科においては暗記する必要はありません。
しかし高校化学や大学受験においては覚えておくと役に立ちますので、余力があればぜひ覚えてしまいましょう。
電池の中で起こる変化
化学変化によって電流を流す仕組みをもつものが電池(化学電池)であると学習しました。
では実際電池の中ではどのような反応が起こっているのでしょうか。
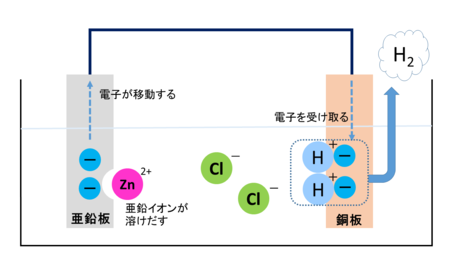
薄い塩酸の中に亜鉛板と銅板を電極とした電池の場合、イオン化傾向の順を見ると、亜鉛の方がイオン化傾向が大きい(イオンになりやすい)ので-極、銅板が+極となります。
各極で起こる変化を詳しく見ていきましょう。
亜鉛板の表面では亜鉛原子が電子を2個失って亜鉛イオンとなります。亜鉛イオンは塩酸の中へ溶けだしていき、電子は電極に残され導線を通って+極へと流れていきます。
銅板の表面では水溶液中の水素イオンが導線から流れてくる電子1個とくっついて水素原子となります。その水素原子が2つセットになり水素分子となり、気体の水素として銅板の表面から空気中へと出ていきます。
身のまわりの電池
普段よく目にする乾電池のように、使うと電圧が低下し元に戻らない電池を「一次電池」といいます。一方スマートフォンやゲーム機に内蔵されているような、充電することによって何度も繰り返し使用できる電池を「二次電池」といいます。
また、これ以外に「燃料電池」と呼ばれるものもあります。これは水素と酸素が化学変化を起こすときに発生する電気エネルギーを直接取り出すもので、反応後には水だけが発生します。
つまり水の電気分解の逆をしているのです。燃料電池は環境への悪影響が少ないと考えられており、現在では自動車などにも使われています。
酸、アルカリとイオン
酸性、アルカリ性の水溶液の性質
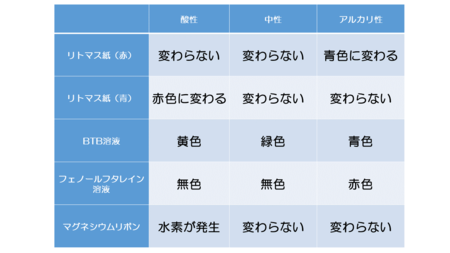
小学校でリトマス紙を使って水溶液を酸性、中性、アルカリ性に分類したことがあると思います。
中学校ではそれにプラスしてBTB溶液、フェノールフタレイン液、マグネシウムリボンを入れたときの反応も加わります。
酸
酸の水溶液には酸っぱい味(酸味)、マグネシウムや鉄などの金属を溶かす、青色リトマス紙を赤色に変えるなどの性質があります。このような酸の水溶液の共通の性質を「酸性」といいます。
酸の水溶液には次のようなものがあります。
- 塩酸(HCl)
- 硫酸(H2SO4)
- 硝酸(HNO3)
- 酢酸(CH3COOH)
化学式を見ると、これらの物質にはすべて水素原子が含まれています。水に溶けると次のように電離します。
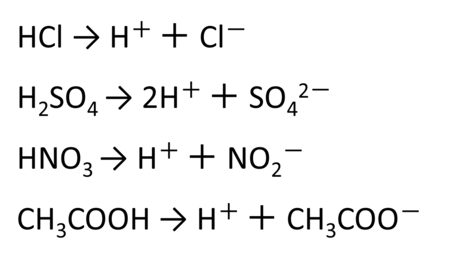
つまり酸とは水に溶けて水素イオンを放出する物質です。
アルカリ
アルカリの水溶液には赤色リトマス紙を青色に変えたり、酸と反応してその性質を打ち消したりするなどの性質があります。このようなアルカリの水溶液に共通する性質を「アルカリ性」といいます。
アルカリの水溶液には次のようなものがあります。
- 水酸化ナトリウム(NaOH)
- 水酸化カルシウム(Ca(OH)2)
- 水酸化バリウム(Ba(OH)2)
- 水酸化カリウム(KOH)
- アンモニア(NH3)
これらの物質は水に溶けると次のように電離します。
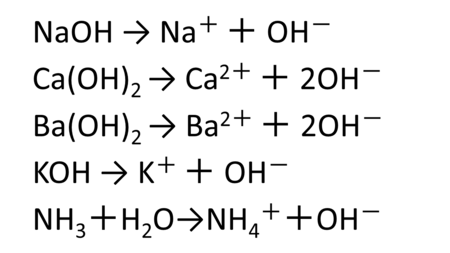
つまりアルカリとは水に溶けて水酸化物イオンを放出する物質です。アンモニアは他のアルカリとは異なり、少し特殊な電離をしますが、水と反応することでやはり水酸化物イオンが出てきますので、アルカリに分類されます。
pH
酸性、アルカリ性の強さを表すのにpHが用いられます。純粋な水(中性)のpHは7を中心として、それより小さい値では酸性、大きい値ではアルカリ性となります。
また数値が小さいほど酸性が、大きいほどアルカリ性が強くなります。
中和・塩
酸とアルカリを反応させると、お互いの性質を打ち消し合います。この現象を「中和」といいます。
酸性の原因である水素イオンも、アルカリ性の原因である水酸化物イオンは、結びつくと水になってしまうのでどちらの性質もなくなってしまうのです。
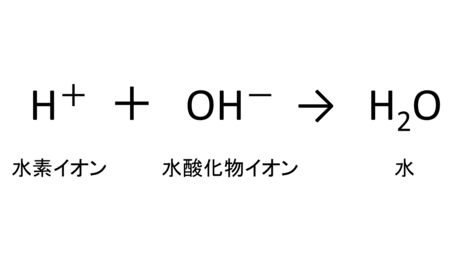
塩酸に水酸化ナトリウム水溶液を少しずつ加えていくと、加えた水酸化物イオンの量だけ中和が起こっていきます。
水酸化ナトリウム水溶液を加えたばかりのとき水溶液が酸性のままであるのは、水溶液中にまだ水素イオンが残っているからです。
ここにさらに水酸化ナトリウム水溶液を加えていくと、全ての水素イオンと水酸化物イオンが結合(中和)します。このときが中性です。中性になった水溶液にさらに水酸化ナトリウム水溶液を加えると、水溶液中の水酸化物イオンによりアルカリ性になります。
中性になったところに焦点を当ててみましょう。
塩酸には水素イオンと塩化物イオンがあります。そして水酸化ナトリウム水溶液中にはナトリウムイオンと水酸化物イオンがあります。これらを混ぜると以下のようになります。
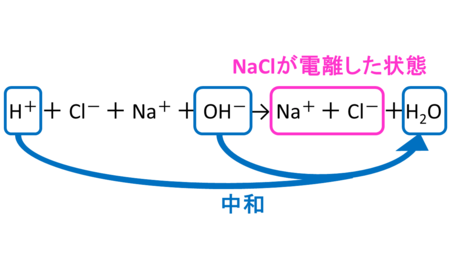
つまり塩化ナトリウム水溶液ができるのです。
この水溶液を蒸発させれば、当然塩化ナトリウムが得られます。
中和では必ず水ができますが、水のほかに酸の陰イオンとアルカリの陽イオンとが結びついた物質(今回の場合では塩化ナトリウム)ができます。この物質を「塩」といいます。
また原子によって陽イオン陰イオンのどちらになるかも変わってきます。これは正直暗記してしまったほうが楽です。中学理科で扱うイオンは種類も少ないですので少しずつ覚えていきましょう
中和反応は「水素イオンと水酸化物イオンで水ができる」を押さえておけば基本はOKです。あとはそれぞれの酸、アルカリでの残りのイオンをくっつけるだけですので難しくないと思います。類題をどんどんこなして練習してみましょう