化学結合 | 0から始める高校化学まとめ
化合物を構成する原子がどういう結合で結びついているのか、これは化合物の性質を理解する上で重要な情報です。この記事では、化合物の結合メカニズムを解説します。
はじめに
ネット上で“化学結合”を検索すると、分子内結合など高校化学の範囲を超えたものが出てくるので、ネットで検索しながら学習する人は混乱することがあります。
高校化学における“化学結合”は、「イオン結合」、「共有結合」、「金属結合」の3つが重要です。大きく分けるとこの3つの結合タイプに大別されます。
化学結合は、原子と原子の結合形態です。この理解に重要な部分は、原子の周囲にある電子の動きです。この記事ではこの電子の動きに重点を置きながら、3種類の化学結合を解説します。
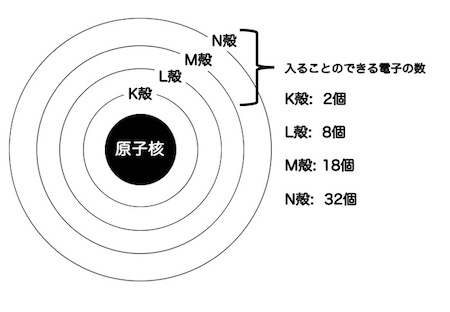
そしてまずは、原子の構造をしっかり復習しましょう。重要なのは、原子の周囲を囲む「殻」に電子がそれぞれ何個入ることができるのか、元素によって最も外側の殻に何個電子が入っているのかが頭に入っているかどうかです。
イオン結合
イオンになる過程を理解する
イオン結合を理解するためには、まずは「イオンを放出すると陽イオンになりやすい。一方で、電子を受け取ると陰イオンになりやすい」を理解しましょう。
例えば、ナトリウムは原子番号が11番ですので、陽子を11個、電子を11個持っています。電子は、K殻に2個、L殻に8個、そしてM殻に1個入っています。この最外殻のM殻にある1つの電子が放出されると、陽子の数は11個のまま、電子の数は10個となります。
プラスの陽子が11個、マイナスの電子が11個の時には差し引きゼロとなって安定していますが、電子が一つ放出されることによって、プラスの陽子の方が多くなり、ナトリウムはプラスの陽イオンとなります。この陽イオンとなるときの電子の配置は、原子番号が最も近い希ガスの電子配置と同じになります。
イオン結合の過程

イオン結合の過程を塩化ナトリウムを例にとって説明します。ナトリウムは先に述べたように、最外殻に1個の電子を持っています。
一方で、塩素は原子番号が17番ですから、17この電子を持っています。K殻に2個、L殻に8個、M殻に7個です。イオンになるときには最も原子番号が近い希ガスと同じ電子配置になりますので、塩素はアルゴンと同じ電子配置になります。
アルゴンは原子番号18番、電子をK殻に2個、L殻に8個、M殻に8個です。塩素がアルゴンと同じ電子配置になるには、最外殻のM殻に電子を一つ取り込むと、M殻の電子数が8個となります。
ここで、最外殻にある1個の電子を放出しやすいナトリウムと、最外殻にもう一つ電子を取り込むと希ガスと同じ電子配置にすることができる塩素、つまり、電子を1個放出したいナトリウムと、電子が1個欲しい塩素、欲しいものとあげたいものが一致します。
このような場合、正と負のイオン間の電気的引力によってナトリウムと塩素が結合し、塩化ナトリウムができる、と記述します。電気的引力は静電気力(クーロン力)と言います。クーロン力は、イオンの価数が大きく、イオン半径が小さいほど強くなり、物質の融点が高くなります。
ナトリウムのような陽性の強い金属元素と、塩素のような陰性の強い元素(非金属元素)の結合の多くはイオン結合です。組成式はNaClになり、「塩化ナトリウム」と読みますが、イオン結合でできた物質の読み方にはパターンがあります。
まず始めに陰イオンの名前が付きます。塩化物イオン、硫酸イオン、リン酸イオンなどです。その後に陽イオンの名前をつけて読みます。塩化物イオン+ナトリウムイオンであれば、塩化ナトリウム。硫酸イオン+カルシウムイオンであれば、硫酸カルシウム、となります。
イオン結合の性質
イオン結合でできた物質の結晶は、共通した性質があります。イオン結合は強い結合なので、融点、沸点は高いものが多いことが第一の特徴です。イオンを結合させている静電気力(クーロン力)はイオンの価数が大きくなるほど、またイオン半径が小さいほど強くなります。
イオン結晶は硬度は高い、つまり硬いのですが、外からの力に対して弱く、もろくて割れやすくなっています。硬いがもろいというのは矛盾しているように感じられますが、これは硬いにも関わらず、外からの力で結晶の列が簡単にずれてしまうので、“割れてしまう”ためです。
イオン結晶、つまり固体は電気を通しません。しかし熱を加えて液体にするとイオンが自由に動けるようになるので、電気を通すようになります。イオン結晶は水に溶けやすいものが多く、水に溶けると陽イオンと陰イオンに分かれます。イオン結晶のように陽イオンと陰イオンに分かれる物質を電解質、グルコースなどのようにイオンを発生せずに水に溶ける物質を非電解質と言います。
最後に、名前、組成式、性質を絶対に覚えておきたい物質を挙げます。食塩とも呼ばれる塩化ナトリウム、石灰石の形で存在する炭酸カルシウム、生石灰と言われる酸化カルシウム、消石灰と言われる水酸化カルシウム、これらは必ず学習して下さい。
共有結合
気体の分子を形成する共有結合
空気中に存在する窒素、酸素などの気体は、原子の状態ではなく、いくつかの原子が結合した分子の状態で存在します。これらの分子は、共有結合によってH2、O2などの形で存在しています。
水素原子は電子をK殻に1つ持っている元素です。K殻は2つまで電子が持てますので、水素原子のK殻は、電子を入れる余裕が1つあります。
ここに同じ水素原子が来ると、2個の水素原子のK殻が重なり合い、お互いの電子を共有する現象が起きます。K殻が共有されると、それぞれの水素原子がもっている原子が共有されたK殻に入り、電子は2個となります。これはヘリウムの電子配置と同じになります。
では酸素の場合はどうなるのでしょうか?酸素の場合、最外殻のL殻に6個の電子を持っています。酸素に最も近い安定した元素はネオンで、ネオンはL殻に8この電子を持っています。つまり、酸素はあと2個の電子を受け入れることができます。
この時、酸素原子はL殻の2つの電子をそれぞれ出し合い、計4個の電子を共有します。酸素原子が単独で持っている6この電子のうち、2個を共有のために使います。残ったのは4個。この4個が酸素原子単体で保有している原子です。
そして、共有している電子が自分の2個と、相手の2個、計4個です。この4個がL殻に入ることによって、L殻には8個の電子が存在している事になります。これでネオンと同じ電子配置になる事ができました。
共有結合は不足する電子を共有することで補い合い、希ガスと同じ、つまり安定した元素と同じ電子配置にする結合です。
共有結合で重要な用語と分子の表し方
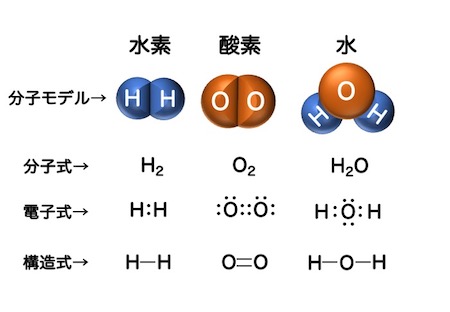
電子は2個で1ペアと考えるとわかりやすくなります。電子式はそのための式で、2つの電子で1組として表します。この時、2つの電子で対を作っている電子と、対を作っていない電子があります。対を作っている電子を電子対と呼び、対を作っていない電子を、不対電子と言います。
不対電子があると、元素は不対電子を出し合って電子を共有します。これによって成立した電子対を、共有電子対と言います。また、共有に関与しない電子対は非共有電子対、または孤立電子対と呼ばれます。
分子の表し方
共有結合を持つ分子は、モデルや式で学習すると理解しやすくなります。図に示したように、分子モデル、分子式、電子式、構造式でそれぞれの分子を表せるように学習しましょう。
構造式ですと、結合が単結合か、二重結合かがわかりやすくなります。この構造式と電子式を見比べると、共有結合における二重結合、三重結合の意味が把握しやすくなります。
1対の共有電子対を1本の線で表したものを価標と言います。この価標を用いて分子内の原子の結びつきを示した式が構造式で、共有結合の理解には必須です。
さらに、不対電子の数=価標の数=原子価、はキッチリ暗記しておきましょう。記述式の試験に対応しやすくなります。
ここまでイオン結合と共有結合について解説してきました。非金属元素同士の結合は主に共有結合によって結ばれています。一方で、金属元素と非金属元素が結合する場合は、主にイオン結合で結ばれます。
配位結合
共有電子対の電子は結合する原子同士から提供される結合をここまで解説してきましたが、一方の原子からのみ提供される結合もあります。この結合は配位結合と呼ばれ、共有結合の中で特別な結合とされています。
配位結合をする物質は、錯イオンがよく知られていますが、他にもアンモニウムイオン、オキソニウムイオンも配位結合によって結びついています。
アンモニウムイオンは、NH4+で表され、窒素原子に4つの水素原子が結合しています。この時、4つ目の水素原子が結合するとき、電子対は窒素から2個提供されて水素原子と結合します。
オキソニウムイオンは、H3O+で表されます。酸素原子1つに3つの水素原子が結合しますが、この場合も3つ目の水素の結合は酸素側から電子2個の提供を受けて結合します。
分子の極性
共有結合における共有結合は、位置的に2つの原子の中間にあるわけでは内場合が多く、どちらかに偏っています。どちらの原子が電子を引き寄せやすいかに依存してこのような偏りが生じます。これが電気陰性度です。
電気陰性度の違いによって、結合に偏りが生じること、これを極性がある、と表現します。2つの原子が共有結合で結合したとき、2つの原子間の電気陰性度の差が大きければ大きいほど、極性は強くなります。
一般的に極性が弱い分子は安定していると誤解されがちですが、ある意味では安定で、ある意味ではそうではありません。
二酸化炭素は炭素と酸素の電気陰性度が互いに打ち消し合うために、無極性分子になります。しかし安定した物質である水は、酸素側に偏る極性分子です。
極性分子か、無極性分子かは次の事柄をキーワードとして学習しましょう。
・単体で存在していれば無極性分子。
・異なる2つの原子の化合物は極性分子。
・多原子で形成される化合物の場合、対称構造(直線形など)の場合は無極性分子、非対称構造(折れ線など)は極性分子。
分子間力と水素結合
無極性分子でも分子間には弱い力が働いています。これをファンデルワールス力と言います。ファンデルワールス力に代表される、分子間に働く弱い力を分子間力と呼びます。ファンデルワールス力は、分子量が大きいほど強く働く傾向があります。
極性分子の場合、電荷の偏りが生まれて静電気力が発生するので、無極性分子よりも分子間力は強くなります。そのため、極性分子の方が融点や沸点は高くなります。
このような結合の中で、電子を1つしか持たない水素は、やや特殊な働きをすることがあります。
もともと1つしかない電子を別の原子に引き寄せられてしまうと、水素の原子核は電子による囲いが消えて、裸の状態になります。このような状態になると水素原子は他の分子、特に電気陰性度の大きな原子の非共有電子対と結びつくようになります。
水素の電子が「イ」という原子に引き寄せられて結合すると、水素は述べたように裸になります。そこへ非共有電子対を持っている「ロ」という原子が来ると、水素はその電子対を受け入れて、水素と「ロ」が結合します。
このように、水素を挟んで「イ」と「ロ」が1つの化合物を作ります。つまり水素が結合の橋渡しをするのです。このような結合を水素結合と呼びます。
金属結合
金属元素は、イオン化エネルギーが小さく、原子が持つ価電子は原子から簡単に離れてしまいます。それが原因で、金属原子同士は、それぞれの原子の最外殻は互いに重なることが簡単に起きます。
こうして原子同士が結合すると、原子から離れやすい価電子は、重なっている電子殻を利用して簡単に動き回るようになります。このような電子を自由電子と言います。
この自由電子がそれぞれの原子に共有されてできる結合が金属結合です。
自由電子の存在によって、金属は熱や電気を通しやすいという性質を持ちます。
また、共有結合のように方向性が決まっている(極性、無極性と分子モデルを考えるとわかりやすいです)結合と異なり、結合が働く方向が全て同方向に働きます。これによって、金属は薄く広げることもできるし(展性)、引っ張って伸ばすこと(延性)もできるようになるのです。
金属結合は、
・自由電子が全部の原子に共有される。
これをきちんと暗記して下さい。
結合の分類
この記事で解説した結合を簡単にまとめてみましょう。
・金属元素の原子
→ 金属結合
→ 電子の受け渡しがあるとイオン結合
・非金属元素の原子
→ 電子の受け渡しがあるとイオン結合
→ 共有結合
→ 分子間力による結合(共有結合の一種)
金属元素の原子は金属結合かイオン結合で、共有結合はしない、一方で非金属元素の原子は金属結合のような自由電子を共有するタイプの結合はしない、と暗記してください。
結合がなぜ起こるのか、つながっているものが具体的に何なのか?を理解すれば、それほど難解な単元ではありません。
まずは比較的シンプルな化合物、例えば水、二酸化炭素、アンモニアなどで学習し、理解できたら他の化合物に応用していきましょう。