物質の反応 〜化学平衡〜 | 0から始める高校化学まとめ
化学反応がバランスを取り、反応に関わる物質の量が見かけ上変わらないのが化学平衡です。実際は、化学反応式の右辺から左辺へ、左辺から右辺へ反応が進んでいます。感覚的につかめそうな単元ですが、中身は計算問題などで構成される精密な分野です。
可逆反応、不可逆反応と化学平衡
可逆反応と不可逆反応

化学平衡の理解の第一歩は、可逆反応と不可逆反応の理解です。可逆反応、不可逆反応の概略を上の図に示しました。
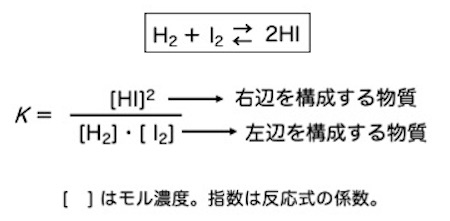
水素とヨウ素を同じ容器に入れ、高温で処理をすると、容器内には水素とヨウ素とヨウ化水素が存在するようになります。これはつまり、水素とヨウ素が反応してヨウ化水素ができるということです。
また、ヨウ化水素を容器内で高温処理した場合も、容器内には水素とヨウ素とヨウ化水素が存在するようになります。
これは、高温条件下では、水素とヨウ素が反応してヨウ化水素が生成し、ヨウ化水素は水素とヨウ素に分解する、2つの真逆の反応が起きていると言うことです。
このように、矢印の右方向、左方向どちらの反応も起こることを、“可逆反応”といいます。一般的に、右向きの矢印の反応を正反応、左向きの矢印の反応を逆反応といいます。
不可逆反応は、炭酸ナトリウム水溶液に塩化カルシウム水溶液を加えたときの反応が代表的な例です。これは是非覚えておきましょう。
炭酸ナトリウム水溶液に塩化カルシウム水溶液を加えると、炭酸カルシウムの沈殿が生じます。この沈殿は、時間が経っても溶けません。つまり、炭酸カルシウムはそのままで残り続けてしまいます。
実際は、逆反応は起きており、炭酸カルシウムは分解されていますが、この反応は非常に遅いため、右向きの反応で完結しているとされています。
完全に右反応のみで、逆反応が絶対に起こらない反応は、図に示したプロパンガスの完全燃焼が挙げられます。
プロパンガスが完全燃焼すると、二酸化炭素と水が生成されますが、この2つの物質からプロパンガスが生じることはありません。
このような反応は、一方向への反応は起きるが、逆方向への反応は起こりません。こういった反応を、不可逆反応と言います。
化学平衡
化学平衡の状態は、可逆反応において、右向きの反応の速度 = 左向きの反応の速度、となる状態です。別の言い方ですと、正反応の速度 = 逆反応の速度、となります。
各成分を構成する物質の量は一定で、見かけ上は何も起きていないように見えますが、正反応と逆反応の速度が同じであるため、図に示した例ですと、水素はヨウ素と結合して量は減るのですが、同時にヨウ化水素が分解されて水素が発生し、使われた水素の分を補充する形になるため、水素の量が変化しません。
化学平衡の定義を文章で書くと、「正反応の速度と逆反応の速度が等しくなっている状態」となります。
エンタルピーとエントロピー
この単元では、エンタルピーとエントロピーという言葉が使われる事があります。問題の中で出てくるとすれば、難問の範疇に入る問題に使われる言葉です。
ただ、エンタルピーとエントロピーという言葉の意味を知っていれば、解ける問題がほとんどです。
エンタルピーは熱エネルギーの高低を意味する言葉です。外部に熱を出すと、エンタルピーが下がると言い、熱を加えられる、吸熱するとエンタルピーが上がる、と言います。
エントロピーは、分野によって定義が微妙に違うので説明が難しいのですが、高校化学の段階では物質やエネルギーの散らばりを表している、と押さえておけば大丈夫です。
水に砂糖を加えると、溶けながら水全体に拡散していきます。また、やかんをガスにかけると、火に近いところから熱がやかんの水全体に拡がっていきます。これがエントロピーと呼ばれるものです。
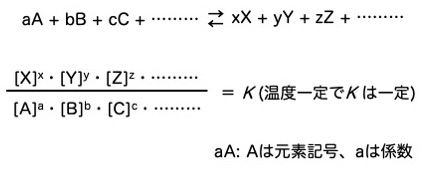
化学平衡の法則
上の図に示した式を、化学平衡の法則、または質量作用の法則と呼びます。そして、Kの値は平衡定数と言われます。
平衡定数は、化学反応の平行状態を、物質の存在比によって示したものです。平行状態でのKの値は、温度が決まればそれぞれ固有の値です。言い方を変えると、ある反応における平衡定数は、温度が一定ならば常に一定です。
化学平衡の法則を一般式化すると、以下の図のような式になります。
覚えておかなければならないポイントは、使うのは平衡状態における各物質のモル濃度と、平衡定数を求める式では、左の反応物のモル濃度が分母になることです。
これが化学平衡の基礎的な事項です。ここについては、問題集で問題に慣れなければならないところです。基本的な事を読んだだけでは、試験では点数が取れません。とにかく問題に慣れましょう。
化学平衡は、温度が一定であると平衡定数が一定、つまり、反応物と生成物の物質量の比が一定です。
また、圧力も平衡状態に関係します。圧平衡定数として表される数値が高校化学の範囲に設定されています。
この圧平衡定数を算出するには、気体であることが前提条件です。そして、平衡定数を算出したときにはモル濃度が必要だったように、圧平衡定数の算出には、反応に関わる各気体の分圧が必要です。
圧平衡定数は、濃度平衡定数との関係があります。これは気体の状態方程式、pv = nRTを使って関係式を作ることができます。詳しい原理については、次の化学平衡の移動の章で述べます。
化学平衡の移動
可逆反応が平衡状態にあるとき、反応の条件をを変えると、正反応と逆反応のバランスが変わり、新しい平衡状態になります。
反応の条件とは、化学反応式を構成する物質の濃度、反応する場所の圧力、温度のことです。
平衡移動するときの原理
平衡の移動については、フランスの科学者、ルシャトリエが見つけた原理があります。これは、ルシャトリエの原理、または平衡移動の原理と言われます。
「可逆反応が平衡状態にあるとき、温度、圧力、物質の濃度などの反応条件を変化させると、その条件の変化を和らげる方向に反応が進む。この結果、新しい平衡状態が生まれる。」
これがルシャトリエの原理です。それでは、条件ごとにどう変化するのかを見ていきましょう。
平衡移動と濃度変化
平衡状態にある反応を構成している物質Aの濃度を大きくすると、その物質の濃度を減少する方向に平衡が移動します。
また、物質Aの濃度を減少させると、その物質の濃度を増加させる方向に平衡が移動します。
こうして平衡を移動させることによって、反応はバランスを取ります。「濃度の変化を緩和する方向に反応が進み、新しい平衡状態になる。」と一般的には言われます。
平衡移動と圧力変化
圧力変化による平衡移動については、気体での反応で学習しましょう。
反応の場の圧力を増した場合、平衡は圧力を減らす方向、そして分子数が減少する方向に移動します。
一方で、反応の場の圧力を減じた場合、平衡は圧力を増す方向、分子数を増加させる方向に移動します。
このケースでは、反応容器を大きくする、すなわち圧力が減る、または反応容器を小さくする、すなわち圧力が増す、を想像しましょう。
気体の分圧をきちんと把握すれば、それほど難しいところではありません。ここを学習するときには、気体の分圧を意識して学習して下さい。
平衡移動と温度変化
条件の変化を和らげる方向、ということであれば、温度変化については感覚的につかみやすいと思います。
反応条件の温度を上昇させた場合、平衡は温度を下げようとして、吸熱の方向に移動します。逆に、温度を下げた場合、平衡は温度を上げようとして、発熱の方向に移動します。
ここまで読んでなんとなくわかった人もいらっしゃるかと思います。化学反応の条件を変えると、平衡移動はその条件を和らげる方向へ進む。つまり、温度が上がれば下げようとするし、圧力が下がれば上がる方向へと移動します。
電解質溶液の平衡
陽イオン、陰イオンを発生する電解質水溶液にも平衡状態が存在します。
弱酸の電離平衡
酢酸などの弱酸を水に溶かすと、水溶液中で一部が電離して平衡状態になります。
CH3COOH + H2O → CH3COO– + H3O+
CH3COOH + H2O ← CH3COO– + H3O+
このような電離による平衡を電離平衡といいます。
酢酸の電離平衡にも化学平衡の法則(質量作用の法則)が適用されます。これによって算出される定数を、酸の電離定数といいます。この定数も、温度一定のもとで一定の値となります。
価数が2価の酸の場合、電離は多段階に進みます。
まずは、H2CO3 → H+ + HCO3– となり、次にHCO3– → H+ + CO32- と進みます。平衡状態の場合、この逆の反応も進みますので、
H+ + CO32- → HCO3–、そしてH+ + HCO3– → H2CO3となります。
第一段階の電離点数をK1、第二段階の電離定数をK2とすると、この反応においては、
K1 × K2 という化学平衡の法則が成立します。
弱塩基の電離平衡
弱塩基では、“希薄溶液”となり、水溶液中の水の濃度はほぼ一定になります。そのため、電離定数は水を除いて計算を行います。
これによってより正確な電離定数が算出できます。これを塩基の電離定数といいます。そして酸の電離定数、塩基の電離定数は、小さければ小さいほど弱い酸、弱い塩基です。
また、酸、塩基に関わらず、電離度αとの関係も重要です。
酢酸の濃度をc(mol/L)、電離度をαとしたとき、上の図の公式が成り立ちます。ただし、これはcのモル濃度が、0.02 mol / L以上の時のみに成り立ちます。
水素イオンが関連する事項
酢酸ナトリウム水溶液は、水の中で加水分解し、水溶液が塩基性を示します。これは、酢酸イオンが電離によって生じ、この酢酸イオンの一部が水と反応して平衡状態となるからです。
[CH3COOH]・[OH–] / [CH3COO–]・[H2O] = K
となりますが、前の項に述べたように水の濃度はほぼ一定ですので、
[CH3COOH]・[OH–] / [CH3COO–] = Kh
これを加水分解定数といい、温度一定であれば定数は一定です。
この加水分解定数と、電離定数には次のような関係が成り立ちます。酢酸の電離定数をKa、水のイオン積をKw、加水分解定数をKhとすると、
Kh = Kw / Ka
この関係式は、電離平衡においては非常に重要な式です。
緩衝作用
水溶液が酸性か、塩基性かを示すときにpHという単位を使います。これは、水素イオン指数、水素イオン濃度指数と呼ばれるものです。
水のような中性の液に酸性、または、塩基性を示す水溶液を加えるとpHは変化します。10 mlの水に塩酸を0.1 mol / Lの濃度で0.1 ml加えると、pHは7から一気に酸性側に移動し、約3まで変化します。
しかし、ある種類の水溶液に少量の塩酸を加えてもpHが変化しない場合があります。
このように、少量の酸性溶液、塩基性溶液を加えてもpHがほぼ一定に保たれる性質を緩衝作用といいます。
一般的に、「弱酸 + 弱酸から生成した塩」の混合水溶液、「弱塩基 + 弱塩基から生成した塩」の混合水溶液は、この緩衝作用を持ちます。このような溶液を緩衝液(バッファーと呼ぶ場合もあります)と呼びます。
化学平衡における電解質水溶液の平衡は、かなり難解であり、手も足も出ないという人もいます。
電解質水溶液の平衡を理解するには、まずは電解質と電離式を暗記しましょう。どうしても電離定数が気になりますが、電離式を暗記できれば、あとは公式に各物質のモル濃度を代入していくのみですので、意外と簡単に感じられます。
この単元に必要な計算知識
この単元では、解離定数などの計算を使った問題が出題されます。モル濃度、分圧ということを理解すれば、ほぼ小学校で習った算数で解けるものが多いのですが、一部対数関数を使うものがあります。
対数関数は、多くの高校生が苦手とするものですが次の公式をまず覚えましょう。
log28 = 3
これは、2を3乗すると8になる、という意味です。
つまり、23 = 8 ということです。
緩衝作用を証明するときなどにこの対数関数は使われますが、底(log28 の2が底です)は10が使われます。説明しますと、
log10100 = 2、102 = 100、10の2乗は100、ということです。
また、10-5などと表される数字も出てきます。103であれば、10 × 10 × 10 で、1000です。
一方、10-5は、1 / 105を意味します。つまり10-1は、1 / 101 = 1 / 10、これは0.1です。
ですので、10-5は、0.1 × 0.1 × 0.1 × 0.1 × 0.1 という事になります。
計算問題は敬遠しがちですが、上記の事を押さえておけば、あとはそれほど難しくありません。
pHの計算でもlogを使います。pHの計算は、
pH = -log10√cKaで表されます。
√cKaは水素イオンのモル濃度を示しています。ですので、[H+]を使ってもpHが算出できます。
なにはともあれ、電離式の理解、暗記を最優先させましょう。電離式が暗記できていないと、定数を計算するときに、何を代入すれば良いのかわからなくなります。
電離式と、記事に示した法則を押さえることができれば、あとは計算ができるかどうかのみです。