物質の反応 ~酸と塩基、酸化と還元~ | 0から始める高校化学まとめ
酸化・還元はややこしい印象がある単元ですが、ここの考え方、知識を身につけると化学反応式などが理解しやすくなります。試験問題にも頻出の単元ですので、得点力アップのために丁寧に学習しましょう。
この単元に必須の考え方

この単元では「何をどこに渡すのか?」「何をどこから受け取るのか?」という考え方が必須です。この考え方を意識していないと理解に時間がかかります。
酸化されるときには還元されるものがある、還元されるものがあれば酸化されるものがあります。そして、何かを受け取る物質が存在するならば、何かを渡す物質も存在します。
キャッチボールを想像して下さい。
ボールを投げる人がいるから、ボールを受ける人がいます。ボールを投げる人がいなければ、ボールを受ける人は存在しません。
この考え方を意識しながら学習を進めましょう。
酸と塩基、酸化と還元、これらが関係する単元は、化学反応式を書かせる問題から計算問題まで、多様な問題が作られる単元です。
高校化学で扱う単元には多様な問題を作ることができる単元は少なくありませんが、酸と塩基、酸性、塩基性(アルカリ性)が関与するこの単元は、特に重要視される単元です。
わからなくなったら、すぐに「何をどこに渡すのか?」「何をどこから受け取るのか?」に戻って考えましょう。
酸と塩基、おさえておくべきこと
酸と塩基がどういうものなのか、を確実に理解するには、アレニウスの定義、ブレンステッド・ローリーの定義をしっかり頭に入れることが大切です。
この2つの定義には、「何をどこに渡すのか?」「何をどこから受け取るのか?」という考え方の中にある、「何を生み出すのか?」「何を渡すのか?」「何を受け取るのか?」がはっきりと書かれています。
具体的な学習内容は、アレニウスの定義とブレンステッド・ローリーの定義を例に取ると理解できます。この2つの定義は酸化・還元の重要なポイントですので、暗記しながら勉強のコツをつかみましょう。
まず、アレニウスの定義は、「酸は水に溶けて水素イオンを生じる物質、塩基は水酸化物イオンを生じる物質」です。つまり、「酸は水素イオンを生じるので他の物質に水素を与えることができる。」と考えることができます。塩基については、アレニウスの定義のみですと混乱しますのでここではちょっと置いておきましょう。
そしてブレンステッド・ローリーの定義を見ますと、「酸は水素イオンを他に与える物質。塩基は水素イオンを他から受け取る物質。」とあります。酸については、アレニウスの定義と同じ内容を述べていますね。
塩基については、ブレンステッド・ローリーの定義で何を受け取るかが明記されています。この2つの定義をセットにして暗記すると、後が便利です。
そして、“価数”は確実にしておくと今後学習が進みやすくなります。価数についてはちょっと構えてしまう人が多いかもしれません。
酸の価数、塩基の価数が何によって決まるか、これだけをまず押さえましょう。そうすれば学習は進みます。他の必要事項は、その時その時に補足という形で理解していけばいいのです。
まずは、酸の価数は水素イオンになる事ができる水素原子の数、塩基の価数は化学式の中に水酸化物イオンがいくつあるのか?で決まる、これを出発点として覚えましょう。
電離度、水素イオン濃度、pHの計算

酸化還元に関連する、電離度、水素イオン濃度、pHは、計算が伴うため苦手とする人が多い部分です。
ここは教科書などをざっと読んだ後、問題で学習を進めましょう。問題を解くときには、教科書、参考書を見ながら解いてみて下さい。
何問か解いているうちに、計算のパターンがつかめてきます。そのパターンがつかめるまでは、公式などを見ながら解いて下さい。
問題に取りかかる前に、重要な公式、情報をノートにまとめておき、それを見ながら解く、という方法でも構いません。この場合は、問題を解きながら気づいたことを、公式を書いたノートにメモしていきましょう。
こうすることによって、自分だけのノートが完成します。最初から教科書などをきれいにノートにまとめる方法は、時間の割には効果が低いのであまりおすすめしません。
ですが、最低限の情報を書いたノートを作っておき、問題を解きながらそこに追加情報を書いていくことによって徐々にノートを完成させる方が時間的効率はよくなります。
まずは問題集を解きながらノートを完成させる事が目標です。ある程度完成に近づいたな、と思ったら、この電離度、水素イオン濃度、pHの計算は、是非大学入学試験の過去問を解いてみて下さい。
問題集の中には入試の過去問を掲載している問題集もありますが、仕上げは徹底的に入試過去問を解きましょう。
大学入試ではどのようなパターンで出題されるのかをある程度把握しておけば、実際の入試の際に、取りかかりから解答完了までの時間が節約できるようになります。
また、そこまでやっておけば、高校の定期試験で正答率の低いこの分野の問題を成果に持ち込むことができるようになります。
学習して頭に入れて欲しい内容は、
・電離度の計算公式。
・強酸、強塩基、弱酸、弱塩基が電離度の計算から判断できること。
・水素イオン濃度を計算し、酸性、中性、アルカリ性が判断できる。
これらは重要なポイントとなるので、ぜひしっかり学習して欲しい内容です。
中和と塩

中和反応と、それによって生成する塩(えん)の性質は、酸化還元を学習するためには必須の知識になります。
過不足なく中和するときの価数と物質量の関係は公式化されています。中和の公式として掲載している教科書、参考書も多々あります。
この公式はまず最初に暗記しましょう。この公式を暗記せずに、中和滴定の問題を解くことは困難です。
中和については、最後の確認は次のステップで行いましょう。
中和反応が理解できているか?
これは、中和反応の反応式を見て理解できること、簡単なものであれば反応式を書けることが目安です。難しい反応式はすぐに書ける必要はありません。酸化還元の単元の学習が終わる頃に書けるようになれば問題ありませんので、あまりこだわらずに前に進みましょう。
中和の“量的関係”が理解できているか?
公式が頭に入っていればクリアできる部分です。問題集の比較的簡単な問題を解いてみて、その公式が使えればまずは問題ありません。
中和滴定の問題が解けるかどうか?
中和滴定の簡単な問題を問題集から選び、解いてみましょう。ここまでの学習が不完全であれば、全く手が出ないはずです。その場合は、もう一回最初から学習しなおしましょう。
そこそこ理解していれば、計算間違いくらいで、考え方の方向性は正しいはずです。考え方の方向性さえ正しければ、先に進んで構いません。計算力は、復習で何度もこなしているうちにコツがつかめてきます。
塩の性質
塩の性質は、塩の生成反応から入ります。まずは、3種類の酸化物と塩が存在することを覚えましょう。
まずは酸化物です。
・酸性酸化物:これは非金属の酸化物です。
・塩基性酸化物:これは金属の酸化物です。
・両性酸化物:アルミニウム(Al)、亜鉛(Zn)、スズ(Sn)、鉛(Pb)などの酸化物。
そして3種類の塩です。
・酸性塩:H原子を含む塩(HイオンになるHを含むともいう)。
・塩基性塩:OHを含む塩(原子団OHという表現もあります)。
・正塩:上記のH、OHを含まない塩。
塩の生成反応は次の7つの反応を押さえて下さい。
・酸 + 塩基の反応
・酸 + 塩基性酸化物の反応
・酸 + 金属単体の反応
・酸性酸化物 + 塩基の反応
・非金属単体 + 塩基の反応
・酸性酸化物 + 塩基性酸化物の反応
・非金属単体 + 金属単体の反応
この7つの反応の代表的な例は教科書、参考書に掲載されています。“押さえる”というのは、代表的な反応式を暗記すればまずクリアです。後は見たことのない塩の生成反応が出てきたら、7つのうちどれに分類されるかを確認して下さい。
生成した塩と酸、塩基との反応も重要です。覚えておきたい反応はつぎの3つに分類されます。
・弱酸の塩 + 強酸 → 強酸の塩 + 弱酸
・弱塩基の塩 + 強塩基 → 強塩基の塩 + 弱塩基
・揮発性の酸の塩 + 不揮発性の酸 → 不揮発性の酸の塩 + 揮発性の酸
これらは化学反応の遊離反応に分類される反応です。最後の揮発性の酸の塩 + 不揮発性の酸、この反応では、揮発性の酸が期待となって反応系から出て行きます。
この出て行くことが理解できているか?出て行く揮発性の酸は何か?双方の観点から問題が作れるので、出題される頻度が高い反応です。
塩の加水分解
塩を水に溶かしたときに、その水溶液が酸性、または塩基性を示すのは、塩が水との反応で、一部が元の酸、塩基に戻るからです。これを、塩の加水分解といいます。
正塩(H、OHを含まない塩)の場合、塩を生成する化合物同士の組み合わせで、酸性を示すか、塩基性を示すかが決まっています。これは重要ですのでまず押さえましょう。
・弱酸と強塩基が反応してできた正塩 → 塩基性
・強酸と弱塩基が反応してできた正塩 → 酸性
・強酸と強塩基が反応してできた正塩 → 中性
これは非常に便利ですので、必ず覚えましょう。
また、H、OHを含む場合は次の法則が成り立ちます。
・塩の陽イオンとOHイオンが結合しやすい場合 → 酸性
・塩の陰イオンとHイオンが結合しやすいとき → 塩基性
・イオンがHイオンやOHイオンと結合しにくいとき → 中性
この法則は、Hイオン、OHイオンとの結合のしやすさを見抜けないと使えない法則です。ただし、ここまでの基本ができていれば見ぬ事は難しくありません。
これが見抜けるか見抜けないかは、この単元の学習レベルの指標になります。基本的な問題で見抜けるようになるまでは、繰り返し復習してください。
酸化・還元、酸化還元反応
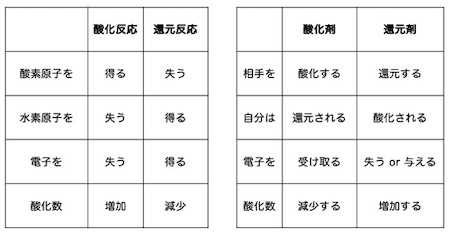
酸化される、とは、
・酸素を得る、または酸素と化合する。
・水素を失う。
・電子を失う。
一方、還元とは、
・酸素を失う。
・水素を得る、または水素と化合する。
・電子を得る。
これらをまず覚えて下さい。
次に、酸化数の決め方を覚えましょう。6つあり、覚えるのがちょっと大変ですが大事なところです。
・単体中の原子の酸化数は0。
・単原子イオンの原子の酸化数は、イオンの価数に等しい。
・化合物において、水素原子の酸化数は+1とする。また酸素原子の酸化数は-2とする。これらをベースに他の原子の酸化数を決める。化合物を構成する元素の酸化数を全て足し算すると、0になる。
・多原子イオンにおける原子の酸化数を全て足すと、イオンの価数に等しくなる。
・化合物の中にアルカリ金属原子があれば酸化数は+1、アルカリ土類金属原子の酸化数は+2。
・金属のハロゲン化物におけるハロゲン原子の酸化数は-1である。
これらは、まずノートに書き写し、このメモを見ながら問題を解きましょう。気になること、気づいたことをそのノートに書き留めていけば、自分なりのまとめノートが完成します。電離度、水素イオン濃度、pHの計算の時に使ったやり方です。
酸化剤、還元剤
最初に、金属イオン化列と反応性、イオン化傾向と反応性を覚えます。
・イオン化傾向の大きい金属は化学反応性が高い。
・イオン化傾向の小さい金属は化学反応性が低い。
・イオン化傾向が小さい金属イオン + イオン化傾向大の金属
→ 反応する
・イオン化傾向が大きい金属イオン + イオン化傾向が小さい金属
→ 反応しない
これを踏まえて、酸化剤、還元剤を学習します。
ここで、冒頭に述べた、「何をどこに渡すのか?」「何をどこから受け取るのか?」を着目点としてまとめてみましょう。酸化反応、還元反応でまとめたものと、酸化剤、還元剤をまとめたものを一緒に並べるとわかりやすくなります(上の表参照)。
気をつけることは、酸化数の増減した原子がその反応中にない場合、その反応は酸化還元反応ではありません。
そして、代表的な酸化剤、還元剤が参考書などに掲載されています。これらは名前を覚えるのと平行して、水溶液中でどう働くか?も暗記して下さい。酸化剤、還元剤の働きを示す式を半反応式と言いますが、水溶液中でどう働くかを示した式が半反応式にあたります。
また、酸化剤、還元剤であっても、逆の効果、つまり酸化剤が還元剤として働き、還元剤が酸化剤として働くことがあります。
酸化剤であっても、反応する物質が自分よりも酸化作用が強ければ還元剤として働きます。逆に、還元剤であっても、自分よりも還元作用が強い物質と反応するときには、酸化剤として働きます。
これはその物質が持つ酸化する作用の強さ、還元する作用の強さに依存するので、相手より強いか弱いか、がポイントになります。
となりますと、酸化作用の強弱、還元作用の強弱を複数の物質でつけることができればよいのです。教科書、参考書に出てくる組み合わせは最低限でも暗記しましょう。
暗記が多い単元ですが、こなれていくうちに、覚えるというよりも、頭の中で導き出せる項目がいくつかあります。暗記することは、まず完璧に暗記しようとは思わず、ある程度暗記できたと思ったら、実際に問題を解いていきましょう。
一度やっただけでは習得が難しい単元ですので、何周か学習することが必要です。そのために、あまり一つのことにこだわらず、理解しきれなかったら短時間で何度も学習するのがコツです。
スマホを使うとき、アプリケーションを使うときに、使用説明書を熟読してから使う人は少ないですよね。多くの人がスマホやアプリケーションを使いながら使用方法を理解します。
学習も同じです。定義、理論を完璧にして学習を進めようとすると、その理解に時間がかかってしまい、肝心のそれを使ってどんな問題が出題されるのかを学習する時間がなくなります。
定義、理論はいったん大まかなところ、または本質的なところを理解したら、学習を進め、問題演習などの実戦で足りない所を補っていくのが効率的な学習の進め方です。



