物質の状態 〜気体・液体・固体〜 | 0から始める高校化学まとめ
物質の三態、固体、液体、気体は、それぞれに性質を持っています。その性質は、高校化学のほとんど全ての単元に関係します。まずは、固体、液体、気体の性質と、それぞれの違いを理解しましょう。この理解には、熱、エネルギーを物差しとして学習し始めると理解が効率的です。
ここで学ぶことのポイント
物質の3つの状態、気体・液体・固体を学ぶこの単元では、次に挙げられることが学ぶ目標になります。つまり、次に挙げることが理解できれば、この単元から出題される大学入試の問題などにはほぼ対応できるということになります。
ただし、この単元と別の単元を使った複合問題が出題されることがあります。そういった問題は、難問の部類に入ることが多いのですが、気体、液体、固体についての性質を押さえておけば、取りかかりやすくなります。
・温度変化に伴う物質の状態の変化を、分子間力、化学結合と関連付けて理解する。
・気体の体積が、圧力と温度に影響を受けていることが理解できる。
・液体への溶解のメカニズムがわかる。
・溶液の溶解度、溶解平衡の関連が理解できる。
・固体を構成する結晶格子の考え方と構造が理解できる。
・コロイド溶液の性質を理解する。
これらを理解するために、必要なツールは以下に挙げるものです。
・物質の変化に関する基本的な原理、法則。
・化学の基本的な原理、法則。
学習する際に、この2つの原理、法則を区別する必要はありません。物質の変化に関する基本的な原理、法則を学習していくと、化学の基本的な原理、法則のうち、物質の状態の理解に必要な原理、法則は身につきます。
まずは熱を理解しよう

熱の出入りは、そのままエネルギーの出入りでもあります。学習の方法は様々ですが、熱、エネルギーの出入りから物質の状態の学習を始めると、比較的理解しやすいと思われます。
固体から液体、そして気体と移行するとき、物質は熱くなる、つまり温度が高くなるという事は、理解しやすいでしょう。同様に、気体からどんどん熱を奪っていくと、最終的には固体になります。
まずは熱とはどういうものなのか?から学習を始めましょう
物質は全て、分子、原子からできています。この原子、分子は常に動いています。ピンとこないかもしれませんが、どんな物質の分子、原子でも動いているのです。しかしこの動きは非常に微細なので、人の目で見てもよくわからないのです。
この運動を「熱運動」いいます。この熱運動が熱、つまりエネルギーを生み出します。まずは、熱は分子、原子運動によって生み出され、その運動が激しければ激しいほど熱は高くなる(温度は高くなる)と理解しましょう。
運動が激しければ熱が高くなるとは、具体的にどういう事でしょうか?
分子、原子は運動しながら、他の分子や原子と衝突します。運動自体も熱を生み出しますし、この衝突が熱を生み出します。そして熱はエネルギーです。これが次の理解のための重要な鍵になります。
物質の状態とエネルギー、圧力と温度の関係
固体、液体、気体の性質を理解するときにまず理解しておきたいことがあります。それは、この3つの状態と熱、エネルギーです。つまり、分子、原子の運動です。
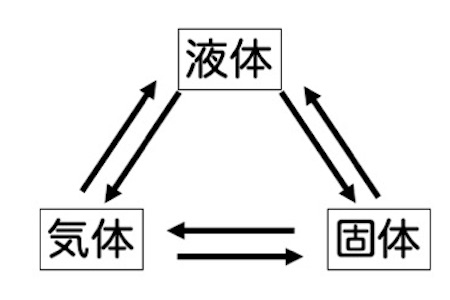
固体に熱を与えると液体になります。そして液体に熱を与えると、気体へと変化します。熱を与えるということはどういう事でしょうか?
まず、固体から見ていきましょう。固体は分子、原子レベルの運動の力よりも、分子達の間の引力の方が強いため、分子は一定の位置に固定され、その場で運動します。
ここに熱を与えると、分子の運動が激しくなります。固体の状態では、分子の運動の力よりも分子間の引力の方が強いのですが、与えられるエネルギーによって、分子の運動の力がどんどん大きくなり、分子間の引力を越える力となります。
分子間の引力を分子の運動の力が越えると、固体は液体になります。つまり、分子達は位置の固定から解放されて、ある程度自由に動けるようになります。この状態が液体です。
液体では分子間の引力がまだ作用しているので、流動性があり、体積もそれほど変化しません。固体ほど位置が固定されるわけではないのですが、それほど分子達は互いに離れることができない、と考えて下さい。
そして液体にさらに熱を与えます。分子の運動はどんどん激しくなり、分子間の引力をはるかに越えて運動するようになります。これが気体の状態です。運動が大きくなることによって分子の互いの距離が遠くなり、分子間の引力がほとんど作用しなくなります。
気体では、固体、液体よりも分子は互いに離れて運動します。そしてランダムに分子達は、別の分子や容器の壁に衝突します。この衝突の力が気体の圧力になります。
ある容器に入っている気体を、さらに小さい容器にそのまま詰め込みます。そうなるとどうなるでしょうか?
元の容器に入っていたときよりも狭い空間に押し込められるので、別の分子や容器の壁に衝突する頻度が高くなります。つまり、“圧力が上がる”ということになります。
気体を圧縮すると圧力が上がる原因はこれです。分子の衝突頻度が高くなるため、衝突によって生み出される圧力が大きくなっていくのです。
固体、液体、気体の性質を理解する、といっても、どの性質を理解すればよいのかつかみ所がないかもしれません。ですので、まずは熱とエネルギーの観点から、この3つの状態を理解することをおすすめします。
そして、固体から液体、液体から気体へと変化する温度を表す言葉があります。なじみのある言葉ですと、融点、沸点です。これらをしっかりと確認しましょう。
これを理解したら、冒頭に挙げた内容を学習していきます。
固体・液体・気体 〜温度変化に伴う物質の状態の変化を、分子間力、化学結合と関連付けて理解する〜
分子間力、という言葉があります。これは、分子の間に働く力をまとめて表す言葉です。先の章で述べた、“分子間に働く引力”はこの分子間力という言葉に置き換えられます。
そして高校化学の範囲でしたら、分子間力は「ファンデルワールス力」と「水素結合」を押さえておけば大丈夫です。
この2つの結合のどちらが、引き離すためにより大きな力が必要なのか?など、ファンデルワールス力と水素結合を比較しながら知識を得ていくと効率的に学習できます。
そして、分子間力でできた固体、分子結晶の性質もここで押さえましょう。代表的なものは、氷、ドライアイスです。ここで分子結晶の性質を学習した後に、固体の学習で結晶格子が出てきますが、その時に再度分子結晶の性質、分子結晶を作る物質を共に復習して下さい。知識の定着がより確実になります。
気体 〜気体の体積が、圧力と温度に影響を受けていることが理解できる〜
圧力と温度は気体の体積に影響を受けますし、気体の体積は圧力と温度に影響を受けます。この双方向の関係を理解しましょう。
ここで重要となるのが、理想気体の状態方程式です。数式が出てくるのでちょっと手を出したくなくなるかもしれませんが、これを理解すれば、気体の体積と圧力、温度の関係はまったく怖くなくなります。
状態方程式を使った問題は、化学の問題集であれば必ず掲載されています。まずは基本的な計算問題を繰り返し解いて、状態方程式をある程度使えるようになりましょう。
最初から難しい問題に手を出すと、何がどうなるのか全くわからないまま時間が過ぎます。まずは基本から、簡単かもしれないという問題でも数をこなして下さい。
液体 〜液体への溶解のメカニズムがわかる〜
まずは溶解、溶質、溶媒、溶液の定義はきっちりと覚えて下さい。そしてイオン結合について基礎的な理解から入ってください。なぜ食塩が水に溶けるのか?などの基本的な事から手をつけるのがよいと思います。
そして溶解は、固体が液体に溶けるだけではありません。気体も液体に溶解します。試験問題としては、固体が液体に溶解することがベースになっている問題の方が多いのですが、気体の溶解メカニズムについて、少しでもいいので触れておくのがよいと思います。
溶解した物質が、溶液の中でどうなっているか、イメージでぼんやりではなく、理屈づけてきっちりと把握しましょう。この後、溶液の反応では、どれだけ溶液内のことが正確に把握できているかが勝負になります。
液体 〜溶液の溶解度、溶解平衡の関連が理解できる〜
ここでは、ヘンリーの法則とボイルの法則が重要です。教科書、参考書を使って完全にこの2つの法則を理解しましょう。ここを曖昧にするとこの後の理解が難しくなります。
別な言い方をすると、溶解度と溶解平衡がわからなくなったら、ヘンリーの法則とボイルの法則に戻れば活路が開ける、ということです。
ただし、この法則が成り立つ物質と成り立たない物質があります。これは教科書や参考書にも記載されていますが、なぜ成り立たないのかという理由が書いていない参考書もあります。必ず、なぜ成り立たないのか?の理由を確認しましょう。キーワードは、“溶けやすさ”です。
そしてここで重要となる事柄の一つに、溶液の濃度があります。g/mlなどは、g(グラム・重さ)をml(ミリリットル・体積)で割りなさい、という意味の単位です。単位を見れば計算方法が書いてある非常に親切なものです。
しかし、高校化学の濃度には“モル”というやっかいな単位があります。このモルは丁寧に、時間をかけて学習しましょう。重さからモルが計算できるか?モルから溶解している物質の重さが計算できるか?これらをチェックしながら進んで下さい。
溶液の単元では、苦手とする人が多いモル濃度、モルの計算ですが、習得してしまえば全く難しくありません。実際に、大学の研究室では、暗算で計算する学生、教員が多くいます(暗算は目安だけで、実験をする際は、当然慎重に計算しますが)。
これは大学の研究室にいる人達が頭がいいからではなく、日常そういう計算をやっているので、慣れてきて暗算でできるようになっただけです。暗算でできるようになる、というのは、計算力よりむしろ計算するパターンに慣れているということです。
欲しい単位の数値を算出するにはどういう計算をすればいいか?がパタンとして頭の中にインプットされているのです。つまり、高校生の皆さんも、モル計算を多くこなすことによって、それほど抵抗なく計算ができるようになります。
固体 〜固体を構成する結晶格子の考え方と構造が理解できる〜
固体を学習するときのポイントは2つです。
1つは、その固体が溶解する物質の場合、どのような状態で水に溶解するのかを具体的に書くことができること。そしてもう一つは、結晶格子で分類、性質の違いを書くことができること、です。
ここは、書かせる問題がよく出るところですので、化学式、文章、どちらでも書けるようにしておきましょう。
コロイド溶液の性質を理解する

コロイド溶液は、2つの相、具体的には、液体の中に固体が溶解せずに存在する状態、つまり同居するというやや特殊な状態と言えます。コロイド溶液の定義は、教科書、参考書で必ず確認して下さい。その時に、コロイド現象についても押さえておくと、後になって便利です。
化学の現象としてコロイドは一般的なものですが、中学、高校の授業内という範疇では、やや特殊なものとして扱われる傾向があります。丁寧に教科書を読み、基本的事項を学習して下さい。
ポイントは、
・コロイド溶液の性質を挙げることができる。
・コロイド溶液の中で起こっている現象を説明できる。
・コロイド溶液は、実社会でどのようなものに使われているか例を挙げることができる。
この3つが学習のポイントになります。理工系志望の高校生にとって、このコロイドというのはかなりの確率で今後出会うものです。
しかし、3つの状態と、固体と液体、液体と気体の関係を理屈で理解すると、驚くほど単純な理屈でこの単元は攻略できます。
そして、この単元は、記憶すること、身につけるべき考え方のパターンが割と多くあります。また、問題も、記述で解答させる問題、穴埋め、化学式を書かせる、さらには計算問題まで、パターンは多岐にわたり、どういう問題が出題されるのかはなかなか想像しにくい単元です。
教科書、参考書を読むという勉強だけにこだわっていると、なかなか進みません。もし進度が遅いなと感じたら、思い切って問題を解いてみて、その答え合わせで解説などから学習していくという方法が向いている人も多いと思います。
また、ノートをまとめることによって学習を進める人は、全てをノートにまとめるのではなく、固体、液体、気体の分子運動の特徴などを簡単にまとめた表を作るなどのレベルでまとめた方がいいでしょう。
間違っても、教科書の文章をきれいにまとめるという方法をしてはいけません。これをやろうとすると、時間がいくらあっても足りなくなります。
一つの定義を説明するための文章は、教科書、参考書によって微妙に違います。一冊の参考書を読みながらノートにまとめるくらいなら、複数の教科書、参考書を読んで、表現方法の違う文章で定義を学んだ方が理解は早くなります。



