物質の構造 〜原子から結晶構造〜 | 0から始める高校化学まとめ
化学の基本となる原子、そしてその原子の集合体である結晶についての勉強方法です。周期表はどこがポイント?結晶構造をどうやって理解すればいい?これらについて解説しています。
化学は物質を扱う分野ですので、その物質の最小単位を知っておく必要があります。物質は何の集合体なのか、を知らないと、性質・特徴をいったん暗記しても、その物質との関連付けが不十分で学習を進めると、すぐに頭から抜けてしまいます。
原子は、元素の最小の単位です。最小の単位、と言われると、それ以上小さなものはないと思われがちですが、実は、原子はさらに小さな、複数の要素から成り立っています。
一般的な「原子」という言葉のニュアンスと、科学的事実の中の「原子」とのズレによって、やや理解しにくい傾向があることは否めません。原子は、それぞれの元素の特徴が初めて出てくる最小の単位、という感覚で学習を進めて下さい。
この記事では、原子から始まり、原子が構成する結晶の構造まで、物質が段々大きくなっていく中、どのような流れで勉強すればいいか、効率のよい理解ができる勉強方法についてを解説します。
周期表を覚えよう
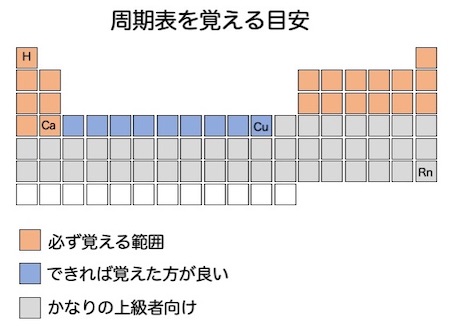
高校化学にまず必須なのは元素周期表の暗記です。しかし、全てを暗記する必要はありません。上の図に、覚える目安を示しました。
赤で示した場所の元素は、理系文系問わず暗記するべき元素です。「水平、リーベ・・・・・・」の語呂合わせがありますが、その語呂合わせの「クラークか」で終わる範囲がこれに該当します。
青の範囲は「できれば覚えた方がよい元素」ですが、理工系、医療系を志望するのであれば、赤の範囲に加えて青の範囲も覚えましょう。
青の範囲には、マンガン(Mn)、鉄(Fe)、銅(Cu)といった、無機化学を学習する際に重要になる金属元素が含まれています。後々になって必要になってきますので、ここで覚えてしまいましょう。
そして、灰色で示した範囲は、化学の専門性の高い職業を希望している人向けです。ランタノイド、アクチノイドを含むので、元素数はかなり多くなります。
高校化学で、灰色で示した範囲まで覚えて役に立つのかどうなのかですが、率直に言ってあまり役には立たないかもしれません。ただし、ランタノイド、アクチノイドは周期表のどこに位置するのかくらいは覚えておいてもいいかもしれません。
元素を分類する方法の一つとして、「族」があります。
水素があるタテの列を1族として、順番に番号を振っていき、ヘリウムの列が18族になります。
また周期は、水素があるヨコの列を1として、一番下の列が7とされます。
周期表をしっかり暗記して、紙の上にパッと書ければ、どの元素が何族で、周期はどこなのかをすぐに割り出せるようになります。
まず重要なのは「族」です。機械的に番号を振っていけばよいので、まずは自分で周期表に番号を書き込んでみて下さい。
原子番号順に元素を覚えただけでは、問題を解くときに不便です。周期表は順番だけでなく、周期”表”としてまるごと覚えた方が後々便利です。
元素の種類とその性質
さらに、元素はいくつかのグループに分けられます。自分が覚えた周期表の元素が、どのグループに属しているかを覚えて下さい。下の図に分類を掲載しました。
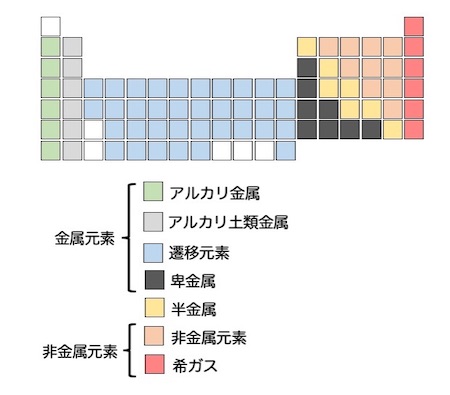
この周期表を完全に覚えてから先に進む、という方法はあまり効率がよくありません。化学の学習を進めながら、1日10分から20分くらいを周期表の暗記に割く、というやり方で、少しずつ覚えていきましょう。
覚えていく過程で、このパターンで分類される元素群の性質をそれぞれ把握すると、後で役に立ちます。
完全に覚えた後も、定期的に記憶がちゃんと保たれているかどうかをチェックする必要があります。とにかく、絶対に覚えておかなければならないところです。
原子の構造
原子は最小の単位と言われますが、実は複数の要素があります。原子は、原子核とその周辺に存在する電子、そして原子核は陽子と中性子から構成されます。
この構造は様々な教科書、参考書で図に表現されていますが、実際の原子は、原子核の周辺に電子が雲のように存在し、境界がはっきりしません。
この原子の構造についてあまり真剣に考えてしまうと、混乱のもとになってしまいます。
教科書、参考書などの図は「便宜上こうやって表現しているだけ」「わかりやすいようにこう表現しているだけ」と考えて(または開き直って)納得しましょう。教科書などで原子を球体で表現しているのは図にするときに便利かつ理解しやすいということで、このような表現方法になっています。
そして、電子です。電子殻、つまり電子の軌道集合体は、どこに電子が配置されるのか?が重要です。これは確実に頭に入れておきましょう。結合を理解する際に便利です。
原子に関係する数字
原子について学習するとき、原子番号と質量数を避けて通ることはできません。
まず、原子番号は何を表しているかを押さえましょう。そして質量数は、周期表の数字を暗記するだけでは解けない問題が存在するので要注意です。
まずは、質量数は何の数なのかを理解しましょう。質量数の概念は少しややこしく感じる人もいるかもしれません。
そういった人は、基礎的な方向、簡単な方向へ進んでわかりやすく理解するのではなく、むしろネットなどで専門的な記述のある所での理解を試しましょう。高校化学の範囲を逸脱した内容に触れた方がわかりやすいケースもあります。
そして元素には同位体というものがあり、これに質量数は影響されます。これはしっかり覚えておいて下さい。
例えば、炭素は12ですが、正確には12.011です。なぜ12.011になるのか?を教科書などで理解して下さい。同位体の存在比から正確な質量数を求める計算問題は頻繁に出ます。一度理解すれば、この計算問題はそれほど難しくありません。確実に点が取れる問題の一つにしましょう。
結晶の構造
「なんだ、簡単じゃないか」と思う方が多いと思いますが、記述するときに間違えるケースは珍しくありません。原子と分子の区別を確実に書いたり口に出したりできるようにしましょう。
そして、その原子、分子の集合体である結晶の理解に進みます。
結合の種類を学習する
結晶は、分子の結合で作られます。この結合の違いによって、4種類の結晶に分けられます。結合は、その物質の性質に大きく影響します。それぞれの結合についての情報をしっかり頭に入れて下さい。
まずは、次の4つの結合を覚えましょう。
1.分子間力による結合
2.共有結合
3.イオン結合
4. 金属結合
名前を覚えたら、どんなメカニズムで結合しているかを学習しましょう。
結晶の種類
そして次に、結晶の種類を覚えます。これは結合の違いによって分類されているので、結合の種類の数と同じく4種類です。
1.分子結晶(分子間力による)
2.共有結合結晶(共有結合による)
3.イオン結晶(イオン結合による)
4.金属結晶(金属結合による)
さらにこの4種類の結晶の性質を覚えます。覚えるときには以下の事柄に焦点をあてて覚えて下さい。
1.硬さ
2.融点は高いのか低いのか
3.電導性(固体の場合と液体の場合で違うことがあるので注意)
硬さでは、延性(引っ張ったらどこまで伸びるか)、展性(薄く広げたらどこまで拡がるか)を注意して下さい。重要なポイントです。
そして、硬さについては結合の性質によって決まります。結晶の硬さと結合の種類はセットで頭に入れましょう。
結晶の構造
結晶の構造は、まず金属結晶から学習しましょう。
結晶の構造を理解するときに、重要な言葉があります。それは、”配位数”と”充填率”です。
配位数とは、結晶の中のある粒子が、何個の粒子に囲まれているか?を表す数字です。そして、充填率は、単位格子中の空間内で、粒子の占める体積のことです。
粒子は球状として考えます。箱にボールを詰めたところを想像して下さい。
ボールとボールの間には隙間ができますよね?
箱の体積からその隙間の体積を引くと、計算された値は箱に詰め込まれている球の総体積になります。この球の総体積を箱の体積で割り、100をかけます。こうすると、結晶中、粒子がどれくらいの体積を占めているのか、パーセントで算出できます。
この2つの数字、配位数と充填率は、試験に出される数字ですので、結晶ごとに覚えるか、算出できるようにしておきましょう。
そして金属結晶の構造ですが、つぎの3つのどれかになります。
1. 体心立方格子
2. 面心立方格子
3. 六方最密構造
どれになるかは元素によって違います。メジャーな金属元素はどの構造なのかは覚えておくと便利です。
そして粒子がどのように何個並ぶのかは必ず把握しましょう。繰り返し関連問題を解くのが効果的です。
さらに、球体で表される粒子で構造を表すと、球状の粒子が丸々一つ結晶に入っているものと、切断された形で入っているもの、この2つが存在します。
例えば、4分の1に切断された球体(粒子)が4つ入っていれば、それで1個分の球体(粒子)となります。
問題を解く際には、切断された状態で表されている粒子が、何分の1に切断されているのかを正確に把握する必要があります。
2分の1なら球体はどんな形か、4分の1ならどんな形か、を予め把握しておくと、その知識は金属結晶についての問題を解くときに心強い味方になります。
イオン結合によって形成されるイオン結晶の構造は次の3つです。
1. 塩化ナトリウム型
2. 塩化セシウム型
3. 硫化亜鉛型
出題傾向は、やや塩化ナトリウム型と塩化セシウム型が厚く、硫化亜鉛型が少ない印象です。この3つの構造も、紙に構造を書いてみましょう。その方が、記憶、そしてその記憶の定着に効率的です。
配位数を考えるときには、着目する粒子が陽イオン粒子だとすれば、配位される粒子は全て陰イオンになります。これは覚えておきましょう。
共有結合結晶の場合、重要なことは平面構造が層を作っているということです。
金属結晶やイオン結晶のような、結晶構造の詳しいところを問う問題は出題されにくいのですが、性質的なところは問われることが多いので、構造と性質の関係、そして、どうして黒鉛のみが電気を通すのか?の理由は押さえておきましょう。
最後に分子結晶です。分子間力で結合するとされています。
分子間力は電磁気学的な力の総称で、実は4種類の結合力をまとめた呼び方です。正確には、ここにイオン結合も「イオン間相互作用」として入ってきますが、「結晶構造の理解においては別」と考えて下さい。
あくまで分子間の相互作用で結合しているものが分子結晶です。しっくりこない人は、「水素結合で構成された水素結合結晶(水が代表的)とファンデルワールス力で構成されたファンデルワールス結晶をまとめて分子結晶と呼ぶ。」と覚えて下さい。
4つの結晶の硬さ、結合の強さは相対的に比較した内容が出題されることがあります。4つの結晶を硬い順に並べる、結合の強さ順に並べる、はできるようになっておいてください。
結晶構造は、様々な単元と複合的な問題を構成して出題されます。特に、アボガドロ定数についての単元で複合問題に出会ったら、こまめに結晶構造の知識を確認しながら学習を進めて下さい。
高校化学は全般的にそうですが、ここで重要なのは、とにかく書いて考えるということです。
きれいにノートにまとめる必要はありません。とにかく書いて覚える、問題を解くときには必ず図などをラフでいいので書いてみる、が大事です。
特に周期表を暗記するときには、「水平、リーベ・・・・・」と唱えながら、周期表を紙に書いていきましょう。丁寧に書く必要はありません。とにかく頭に入れるために書くので、自分で読める程度の文字で問題ありません。
質量数、原子番号も書きながら覚えるのが効率的です。
さらに、結晶についても、金属結晶の3つの構造は、絵に描いてみましょう。これも自分がわかる程度で構いません。教科書には必ず金属結晶の3つの構造は図示されています。それを見て、自分でも書けるようにしておいて下さい。
高校化学の基礎の基礎ともいえる単元です。きっちりやることが大事ですが、あまり時間をかけるのは得策ではありません。ある程度できたら先に進みましょう。
前に進んでも、この単元の要素を含んだ問題には常に出会います。その時に知識が曖昧であったり、暗記したはずの箇所が抜けていたりしたら、またこの単元に戻ってきて下さい。
原子、分子、結晶構造を使った問題を解くときに、間違ったりわからなくなったりしたら、そのままにせず、すぐに戻りましょう。そうすると着実にこの単元の内容が身につきます。先に進んでは戻り、また進んでは戻る、を繰り返すことによって、この基礎的な単元がしっかり定着します。




