物質の反応 ~反応と反応速度~ | 0から始める高校化学まとめ
高校化学の最重要単元とも言える反応と反応速度です。ほとんどの大学入試試験の化学では、この単元から出題されています。比較的解きやすいものから難問まで、幅広く出題されていますので、時間をかけて学習しましょう。
化学式と化学反応式
高校化学の“反応”を学習するにあたり、まずは化学式と化学式の区別を付けましょう。
化学式は1つの物質を元素記号で表したものです。一方、化学反応式は化学式を使って表した物質の反応を表したもので、複数の元素記号が出現します。
化学反応式は、反応の部分を矢印で示します。この矢印を挟んだ両辺は、元素の数が揃っていなければなりません。
左辺に3つの水素(H)があった場合、矢印を経由した右辺にも3つの水素がなければならない、ということです。石灰石と塩酸の反応を例にして解説します。
出てくる元素は、Ca(カルシウム)、C(炭素)、O(酸素)、H(水素)、Cl(塩素)です。
係数を考えずに書くと、CaCO3 + HCl → CaCl2 + H2O + CO2 になります。
矢印の左辺には、Caが1個、Cが1個、Oが3個、Hが1個、Clが1個あります。そして右辺には、Caが1個、Cが1個、Oが3個、Hが2個、Clが2個あります。
このままの式ですと、矢印を挟んだ両辺で、O、H、Clの数が一致しません。
そこで、HCl、つまり塩酸を1分子ではなく、2分子にして以下の式を作ります。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
こうすると、矢印を挟んだ両辺の元素の数が一致します。
化学反応式を作るときは、
1. 矢印を挟んで反応物と生成物を両辺に書く。
2. 1つの物質の係数を全ていったん1とする。
3. 両辺の元素(原子)の数を合わせる。
4. 係数の1を省略する(1XをXと書くことと同じ理屈です)。
この手順で行います。
化学反応式が書けるようになるためには、まず、高校化学で学ぶ化合物の化学式は暗記が必要です。これは暗記するしかありません。
次に、化学反応式です。化学反応式は、反応する物質と生成する物質が頭の中に入っている、または考え出さなければなりません。
まずは暗記するところから始めましょう。化学反応式の暗記は、反応物と生成物をとにかく暗記すれば、あとは元素の数を合わせることで化学反応式が完成します。
上に挙げた例(CaCO3 + 2HCl → CaCl2 + H2O + CO2)ですと、
1. 石灰石(炭酸カルシウム)、塩酸、塩化カルシウム、水、二酸化炭素の化学式を覚える(元素記号で書けるようにする)
2. 石灰石に塩酸を加える→塩化カルシウム、水と二酸化炭素ができる、と暗記する。
3. まずCaCO3(石灰石)+ HCl(塩酸) → CaCl2 (塩化カルシウム)+ H2O (水)+ CO2(二酸化炭素)を書いてみる
4. 両辺の元素の数を合わせて、CaCO3 + 2HCl → CaCl2 + H2O + CO2 を完成させる。
という手順になります。1と2が逆でも構いません。
化学反応式は試験問題に頻出です。高校化学の教科書に出てくる反応については、全て書けるようにしましょう。
化学反応の分類
化学反応式は、高校化学で学ぶ重要事項の一つです。大学入試の化学では、ほとんどの試験で何らかの形でこの化学反応式が出題されます。
高校化学で学習する化学反応はいくつかに分類することができます。
中和反応、酸化還元反応、遊離反応、沈殿反応、錯イオン形成反応がその分類にあたります。このうち、中和反応、酸化還元反応、沈殿反応は非常に重要です。
これらがどういった反応なのか、そして勉強のコツは?を見ていきましょう。
中和反応

中和反応は、酸性物質と塩基性物質(アルカリ性物質)が反応して、「塩」を生成する反応です。
塩は「えん」と読み、酸性物質由来の陰イオンと、塩基性物質由来の陽イオンがイオン結合して生成する物質の総称です。
ここでまず重要なのが、酸性物質と塩基性物質はどういうものか?です。これらを理解してから反応の学習に入るのが望ましいのですが、ややこしいのでなかなか頭に入らないかも知れません。
もしなかなかこの2つの物質を把握できないのであれば、とりあえず、酸とは水に溶けると「水素イオン+陰イオン」を生成する、塩基は水に溶けると「水酸化物イオン+陽イオン」を生成する、と理解しておきましょう。
中和反応は、酸性物質と塩基性物質の反応ですので、生成物は中性になります。しかし必ずしもpH7になるとは限りませんが、これについては高校化学の範囲からちょっと外れますので、「pH7周辺」と覚えておいた方がいいと思います。
また、中和反応では塩の他に、ほとんどの場合で水が生成することは覚えておきましょう。
酸化還元反応
酸化還元反応とは、酸化される、または還元される反応ですが、1つの反応の中に、「酸化されるものがあれば還元されるものがある」ということはきちんと覚えておきましょう。
酸化還元反応は化合物同士の電子の受け渡しが重要です。ある化合物が電子を受け取るためには、別の化合物から電子が離れなければなりません。
電子を失う、これは酸化です。電子を得る、これは還元です。
つまり、ある化合物が電子を失い(酸化)、その電子が別の化合物に取り入れられる(還元)、こうして1つの反応の中で酸化と還元が起こる、という流れになります。
この反応を理解するには、まずは電子の動きに注意して化学反応式を学習しましょう。酸化される物質と還元される物質を化学反応式内で把握できるようになれば、理解は早くなります。
遊離反応
遊離反応は、弱酸遊離反応と、弱塩基遊離反応の2つを指します。
弱酸遊離反応は、「弱酸を含む塩+強酸→強酸を含む塩+弱酸」です。つまり、強酸で処理することによって、弱酸の物質が生成するという反応です。
弱塩基反応の場合は、酸が塩基にかわり、「弱塩基を含む塩+強塩基→強塩基を含む塩+弱塩基」です。
弱酸を含む塩は、水中で電離して弱酸由来のイオンを生成します。例えば、酢酸ナトリウム、CH3COONaは、水中ではCH3COO– + Na+ になります。
ここに塩酸(HCl)のような強酸を加えます。そうすると、弱酸から生成したイオン、CH3COO–と、強酸のHClから電離したH+がくっつき、CH3COOHができます。このCH3COOHは弱酸です。
理解のコツは、化学反応式を書いて、陽イオンと陰イオンのペアを作る、そのペアは反応物と違うペア(左辺にある化合物ではないペア)を作るということです。実際に化学反応式を書いて学習すると意外とわかりやすい反応と言えます。
沈殿反応

沈殿を生じる反応、これが沈殿反応です。この反応理解には、金属元素のイオン化傾向を抑えることから始めましょう。
イオン化傾向は、元素の周期表を使って表現している教科書・参考書が多く、比較的わかりやすいと思います。
沈殿反応は主に金属元素が入っている反応です。まずは、それぞれのイオンを加えたときに、沈殿が生じる元素を暗記していきましょう。金属イオンは「陽イオン」として表現されます。
暗記は以下の分類によって行います。
・ほぼ沈殿しないイオン。
・塩化物イオン(Cl–)で沈殿する陽イオン。
・炭酸イオン(CO32-)で沈殿する陽イオン。
・硫酸イオン(SO42-)で沈殿する陽イオン。
・クロム酸イオン(CrO42-)で沈殿する陽イオン。
・硫化物イオン(S2–)で沈殿する陽イオン。
・塩基で沈殿するイオン。
塩化物イオン、硫酸イオン、クロム酸イオンについては語呂合わせがあります(上の図)。
錯イオン形成反応
錯イオン反応は沈殿が生じることもあるために、やや複雑と感じる人が多いかもしれません。
錯イオンは、配位結合、水素結合で複数の分子によって形成されるイオンです。英語では、complex ionと言います。このcomplexは「複合体」という意味です。
錯イオン形成反応は別名があり、配位子交換反応とも言われます。問題としては、やや難問から難問に分類されるところです。
高校化学での錯イオンであれば、学習するときに「配位子が交換されているだけ」という事を頭に入れて学習しましょう。
まず、なぜ錯イオンができるのか?から着手して下さい。理解に重要なのはエネルギーと水和です。
「金属が金属イオンとして存在できるのは水和しているから」という所から入りましょう。この水が追い出されて、別のものに置き換わる、これがこの反応の本質です。
反応速度
大学受験の模擬試験などで反応速度を計算する問題が出題されることがありますが、正答率はそれほど高くありません。苦手としている人が多いようです。
しかし、理屈さえわかってしまえば、後は式に数値を入れるだけです。それほど手強いものではありません。
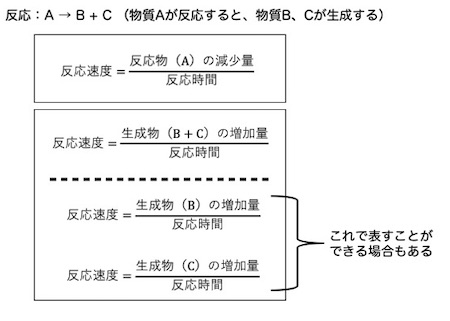
まず、A → B + Cという反応を行うとします。
この反応を開始してから、1分後から5分後の間の速度(平均速度)を求めます。速度を「反応速度」とします。
まず、Aは反応物ですので、反応が進めば減少していきます。1分後から5分後の減少量は、(1分の時点でのAの量)―(5分の時点のAの量)で算出できます。
そしてこの間に経過した時間は、1分から5分ですので、4分間経過したことになります。
ここで、速度と距離の関係式を思い出してみましょう。
速さ × 時間 = 距離、ですね。ある速度に走った時間をかけると、走った距離が計算できます。
化学の反応の場合は、速さ × 時間 = 減少量となります。反応速度に経過した時間をかけると、減少した、つまり反応してしまった物質Aの量が計算できます。
そして、速さを知りたいので、式を変形し、速さ = (減少量)/ (経過時間)とします。
これに当てはめていくと、
反応速度 = [(1分の時点でのAの量)―(5分の時点でのAの量)] / 4分(経過時間)となります。これで、1分から5分の間の反応速度(平均速度)が算出できます。
どうすれば反応速度は変わる?
反応速度の式を図にしました。
図の式を見れば、反応速度が変化する要素がわかると思います。
時間が長くなれば反応物質は減少します。しかし、反応物質量はその時間での量を取りますので、時間を変えればそれに伴って変化し、結局反応速度は変化しません。
となると、上の例で考えれば、1分から5分の間に反応した物質量が増えればよい、つまり減少量が増えれば分子が大きくなって、反応速度が上がります。
生成物の量(ここではモル濃度と表してあります)であれば、4分間の間に10増えていたものが、20増えれば反応速度は上昇することになります。
では、減少量が増えるためにはどうすればいいのでしょうか?
物質が反応するためにはエネルギーが必要です。つまり、反応内でのエネルギーを上げてやればよいのです。
それではエネルギーを上げるためにはどうすればいいのでしょうか?
濃度を大きくする、気体であれば分圧を高くする。
単位時間あたりの分子の衝突が増加します。分子の衝突が増加すると温度が高くなり、反応系内のエネルギー量は増加します。
温度を高くする。
外部から熱、つまりエネルギーを与えて温度を上昇させれば、反応系内のエネルギーが増加します。
これは外部からのエネルギーの供給によって、活性化エネルギー以上のエネルギーを持った分子数が増えるためです。
触媒を加える。
反応に必要な活性化エネルギーのレベルが下がります。
そうなると、相対的に反応に必要なエネルギーを持つ分子数が増加することになります。
反応物の表面積を大きくする。
例えば、粉末を細かくすると、反応系に含まれる全物質量の総表面積が大きくなります。
この時に注意するのは、細かくされた粉末は、1個あたりの表面積は細かくする前よりも小さくなります。しかし、反応系内での粉末の個数が増加します。
砂糖を細かくすりつぶすところを想像して下さい。
砂糖の粉末1個あたりの表面積は、粉末が細かくなりますので小さくなりますが、細かくされたことによって砂糖の粉末の個数が増えます。
小さくなった粉末全ての表面積の和は、すりつぶす前の砂糖粉末の表面積の和よりも大きくなります。
この結果、単位時間あたりの衝突回数が増え、反応系内のエネルギーが上昇します。
反応速度の上昇、減少はエネルギーに依存する場合が多い。
反応物が反応を済ませて生成物になるためには、「反応のためのエネルギー」が必要です。このエネルギーは熱と考えて下さい。
つまり、反応速度はエネルギー、熱に依存する場合が多く、温度が高いときほど反応が速く進む傾向にあります。
反応が速く進むということは、反応物の減少量、または生成物の増加量が大きくなる。逆に、反応物の減少量、生成物の増加量が増えれば、単位時間で割った値が大きくなり、この値は反応速度を示すので、反応速度が速くなります。
まずはここに示した平均反応速度さえ押さえておけば、あとの速度に関する式、計算は難しくありません。平均反応速度を押さえるということは、反応速度の考え方を身につけることですので、応用は簡単にできるようになります。
化合物を元素記号で表す化学式を組み合わせて化学反応式を書かせたり、文章で書かれた反応を化学反応式で書かせる、また穴埋め問題など、出題される問題には多様性があります。
多少時間がかかっても、この単元はじっくりと理解し、やや難問くらいまでは解けるようにしましょう。




