物質の反応 ~電気分解~ | 0から始める高校化学まとめ
電池・電気分解は高校化学の単元の中では、将来かなり役に立つ可能性がある単元です。この分野は今後、かなりの国際的競争が見込まれますので、この辺を理解する人を欲しい理工系大学が今後増えるかもしれません。
電池に関する言葉と原理
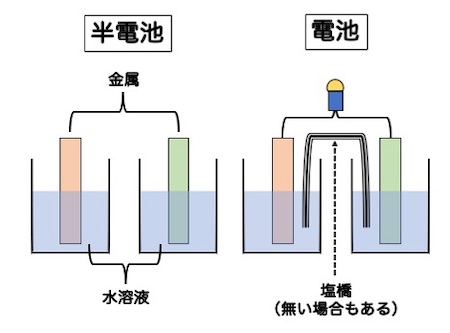
電池はまず半電池を理解しましょう。電池を理解するときには、電極に使われている金属のイオン化傾向の大小を区別できるようにすることです。
金属についてのこの順番をまず押さえます。
Li・K・Ca・Na・Mg・Al・Zn・Fe・Ni・Sn・Pb・(H2)・Cu・Hg・Ag・Pt・Au
これはイオン化傾向が大きい順(Liは大きく、Auは小さい)、酸化されやすさ(Liは酸化されやすく、Auは酸化されにくい)、陽イオンへのなりやすさ(Liは陽イオンになりやすく、Auは陽イオンになりにくい)、という法則で並んでいます。
覚えるには語呂があるので活用しましょう。
理屈に合わない(Li)金借りるな(K・Ca・Na)。間借りあてに(Mg・Al・Zn・Fe・Ni)すんな(Sn・Pb)、ひどすぎるよ(H・Cu・Hg・Ag)借金は(Pt・Au)
そして、基本事項である言葉の意味を確実に押さえましょう。
・電極:水溶液に浸した金属のことです。
・正極と負極:正極はイオン化傾向の小さい方の金属、負極はイオン化傾向の大きい方の金属です。
・電流の向き:電流の向きは電子の流れと逆方向、これは重要です。
・起電力:正極と負極の電位差、これは電圧であり、起電力ともいいます。
電池を考える初歩は、負極を基準に考えると理解しやすくなります。
・まずは、負極はイオン化傾向の大きい方の金属であること。
・負極では、金属は陽イオンになる。
・その金属では電子を失う酸化反応が起こる。
・電子は、負極から導線に流れ、正極へと向かう。
基本的な電池
基本的な電池は、ボルタ電池とダニエル電池です。この2つの電池のメカニズムは完全に暗記する必要があります。
電池の負極では酸化反応、正極では還元反応がおこります。この酸化反応、還元反応を足がかりに、全体の反応を化学反応式で書けるようにしましょう。
ボルタ電池では、負極で亜鉛がイオン化し、電子が放出されます(酸化反応)。この電子は、導線を通って陽極に移動し、陽極で水溶液中の水素イオンが電子を受け取り、水素が発生します(還元反応)。
ダニエル電池は、負極で亜鉛のイオン化(酸化反応)、生成した電子が導線を通って陽極へ、そこで水溶液中の銅イオンが電子を受け取り銅となって析出します(還元反応)。
実用的な電池
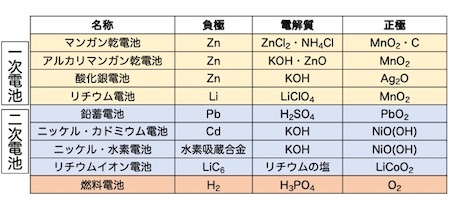
実用的な電池として高校化学で押さえておきたいのは以下の電池です。
・乾電池(マンガン乾電池)
・鉛蓄電池(なまりちくでんち)
・アルカリマンガン乾電池
・リチウム電池
・酸化銀電池
・ニッケル・カドミウム蓄電池
・ニッケル・水素電池
・リチウムイオン電池
・燃料電池
これらの正極、負極に使われている金属、電解質を表に示しました。この表はしっかりと暗記して下さい。
鉛蓄電池の場合、正極と負極の状況を、放電時と充電時に分けて考えなければなりません。鉛蓄電池が放電しているとき、硫酸の濃度が減少し、正極・負極の質量は増加します。一方、充電時は、硫酸の濃度は増加、正極・負極の質量は減少します。これは問題解法のポイントとなる重要な内容です。
理工系のこの方面に進みたい人は受験だけでなく、大学、専門学校入学後も必要になりますし、今後この分野は発展が見込まれる分野です。かなりの数の人材が必要になると予想されていますので、やっておいて損はありません。
電気分解の原理
電気分解は、酸化反応、還元反応を使って理解します。電池を学習した後ですと混乱するかもしれませんが、
電池の負極 → 酸化反応
電池の正極 → 還元反応
こうなりますが、電気分解の時には逆になります。つまり、
電気分解の陰極 → 還元反応
電気分解の陽極 → 酸化反応
となります。
これらは暗記すべき内容です。電池と電気分解が混乱しないように、しっかりと暗記して下さい。
基本的な白金・炭素電極
電解槽の中の液体を電解液と呼びます。白金・炭素電極を使っている電気分解では、電解液ごとに学習して下さい。電解液として使われる溶液は、
・塩化銅(II)水溶液
・塩化ナトリウム水溶液
・硫酸銅(II)水溶液
・水
これらの電解液を使ったときの陰極と陽極でどのような反応が起こっているかを取りかかりとして学習して下さい。
また、次の項目は重要な内容ですので暗記して下さい。
・電子の受け取りやすさの順序
イオン化傾向が小さい金属陽イオン>水>イオン化傾向が大きい金属陽イオン
この場合のイオン化傾向が小さい金属陽イオンは、銅イオン、銀イオン。イオン化傾向が大きい金属陽イオンは、ナトリウムイオン、カリウムイオン、アルミニウムイオンです。
・電子の放出しやすさの順序
単原子陰イオン>水>多原子陰イオン
単原子陰イオンは、ハロゲン化物イオンです。多原子陰イオンの代表的なものは、硫酸イオンが挙げられます。
これを踏まえた上で、電気分解を見てみましょう。この時、銅の動きが出てきます。銅は電極に使われていませんが、電解液中に銅イオンとして存在しています。「電極に銅を使っていないのに、なぜ銅が出てくるの?」と初歩的な混乱をしないように、電極の物質、電解液中の物質は何が存在しているのかを把握してから学習を進めて下さい。
塩化銅(II)水溶液の電気分解
塩化銅水溶液に炭素電極を浸して電気分解した場合、どのような反応が起こるのでしょうか?
陰極では、水分子よりも電子を受け取りやすい銅イオンが電子を受け取ります。電子を受け取ると銅イオンは“銅”となります。銅は「電子を受け取っている」ので、ここでは還元反応が起こっています。
陽極では、水分子よりも電子を放出しやすい塩化物イオン(別名:塩素イオン)が、電子を放出して塩素になります。この反応は、「電子を放出する」ので、酸化反応です。
全体の反応としては、塩化銅(II) → 銅 + 2分子の塩素となります。
塩化ナトリウム水溶液の電気分解
塩化ナトリウム水溶液の電気分解では炭素電極を使います。
陰極ではナトリウムイオンよりも電子を受け取りやすい水分子が電子を受け取り(還元反応)、水素と水酸化物イオンになります。陽極では塩化物イオンが電子を放出し(酸化反応)、塩素となります。
全体の反応は、2分子の塩化ナトリウム + 2分子の水 → 2分子の水酸化ナトリウム + 水素 + 塩素となります。
硫酸銅(II)の電気分解
硫酸銅の電気分解では、白金電極を使います。陰極ではイオン化傾向が小さい銅イオンが還元されて銅になります。そして陽極では硫酸化物イオンよりも水分子の方が酸化されやすいので、酸化反応によって水素イオンと酸素を生成します。
ここで重要なのは、「水は安定した物質のような印象があるが、そうでもないことがある。」ということです。「水は安定だから反応しないとして・・・・・」と考えると間違いの原因になります。
イオン化傾向、電子の放出のしやすさ、受け取りやすさはしっかりと覚えて下さい。
水の電気分解
水の電気分解は、水に硫酸、または水酸化ナトリウムを加えて行います。
硫酸を加えた場合、陰極では電解液中の水素イオンが還元されて水素が発生します。そして容共では水分子が酸化されて酸素が発生します。この陽極で水が分解されているわけです。
一方、水酸化ナトリウムを加えると、陰極ではイオン化傾向の大きなナトリウムではなく、水が還元されて水素が発生します。ナトリウムはイオン化傾向が水よりも大きいので、イオンのままをキープし、代わりにイオン化傾向がナトリウムより弱い水がイオン(水酸化物イオン)を生成してしまうのです。
この電解液中では、陰イオンは水酸化物イオンしか存在しません。ですので、陽極では水酸化物イオンが酸化されて酸素が発生します。
水の電気分解は、硫酸を加えた場合は陽極で水が分解され、水酸化物イオンでは陰極で水が分解されていることをしっかりと押さえましょう。
白金・炭素電極以外のものを使った電気分解
水分子よりも電子を失いやすい、銅の電極が使われた問題が比較的多く出されます。
硫酸銅(II)水溶液に銅電極を入れる、つまり、電解液中には銅イオンが存在し、電極は銅というちょっとややこしい状況です。電極の銅が反応しているのか、電解液中の動画反応しているのかをしっかり区別しましょう。
陰極では電解液中の銅イオンが還元されて銅となります。一方陽極では、電極の銅が酸化されて銅イオンとなって電解液中に溶け出していきます。
まずは、電極が炭素、白金、銅が使われているときの電気分解をしっかり学習して下さい。他の物質でできている電極を使った問題の場合は、イオン化傾向の大小と、電子の受け取りやすさ、放出しやすさを押さえておけば解くことができます。
電気量と物質量の変化

電気分解でもやはり計算問題が存在します。言葉の説明も入れながら、項目別に解説します。
クーロン
1アンペア(1A)の電流が1秒間流されたときの電気量が1クーロン(1C)です。この定義についてですが、アンペアは電流の単位、クーロンは電荷の単位です。アンペアの場合、単位時間のアンペアを、アンペア/時(アンペア毎時)、アンペア/秒(アンペア毎秒)とすると電荷の単位になります。
かなりややこしいと思いますが、アンペアとクーロンの単位は、時代と共に、科学の進歩と共に変わってしまいます。
冒頭に「1アンペア(1A)の電流が1秒間流されたときの電気量が1クーロン(1C)」と書きましたが、定義としては2018年の国際会議で、「アンペアの定義は、毎秒1クーロンの電荷を流す電流を1アンペアとする」に変更されました。
なぜこんなややこしいことになるかというと、1アンペア = 1クーロンとしてしまうと、電流と電荷を同じ土俵に乗せてしまうため、正しくない表現になってしまうからです。
この辺の詳しいことは、理工系の大学に行けば習います。高校化学、物理、生物は最先端の事柄と関わってしまうため、混乱をまねいてしまうことが少なからずあります。ここはしょうがない部分と言うしかないのかもしれません。
とりあえず高校化学の段階では、「1アンペア(1A)の電流が1秒間流されたときの電気量が1クーロン(1C)」でしっかり覚えましょう。指導要領などが改訂されて、「アンペアの定義は、毎秒1クーロンの電荷を流す電流を1アンペアとする」と発表されるまでは、今までの定義で学習するのが安全です。
もし不安であるなら、式を使って覚えておくと、両方の定義を覚える労力が少なくて済みます。
クーロンをQ(単位はクーロン:C)、電流をi(単位はアンペア:A)、電流が流れた時間をt(単位は秒:s)としたとき、
今までの定義:Q(C)= i(A)× t(s)
新しい定義:i(A)= Q(C)/ t(s)
簡単に書くと、
今までの定義:Q = i × t
新しい定義:i = Q / t
これを見て、あれ?と思う人もいるかもしれません。今までの定義の、Q = i × tの式を変形すると、結局は、i = Q / tになります。
ファラデー定数
まず、電気量の単位はクーロン(C)であることをしっかり認識して下さい。その上で、電子1個が持つ電気量はどのくらいでしょうか?
電子1個が持つ電気量は、1.60 × 10-19 Cです。この値は、電気素量と呼ばれます。そして、電子1 molがどのくらいの電気量を持つのかを示したものがファラデー定数です。
1 molは、分子が6.02 × 1023個です(6.0 × 1023 と表している参考書もあります)。つまり、電子が6.02 × 1023個あると電気量がどのくらいか?がファラデー定数です。
電子1個あたりが1.60 × 10-19 C、その6.02 × 1023 倍ですので、約96500 Cです。そしてこの値は1 molあたりですので、96500 C/molと表すことができます。
ファラデー定数は、Fで表しますので、F = 96500 C/molと覚えましょう。
ファラデーの法則
最後に、電気分解における物質の変化量についての法則、ファラデーの法則です。
・電気分解によって、陽極、陰極で変化する物質の量は、通じた電気量に比例する。
・電気分解において、同じ電気医療で変化する物質の量は、物質の価数に反比例する。
ファラデーの法則は、電気分解の法則とも呼ばれます。これだけ読んでもちょっとピンと来ませんよね。
まず、「1 molの銀イオンが銀になるときには、1 molの電子が必要である」を頭に入れましょう。銀イオンはAg+ ですので、1分子の銀イオンが銀になるためには1分子の電子が必要です。ですので、双方同じ個数の分子量が必要となります。よって、1 molの銀イオンが銀になるには1 molの電子が必要になるわけです。
そして、「1 molの銅イオンが銅になるためには、2 molの電子が必要である」を考えましょう。銅イオンは、Cu2+ ですから、1分子の銅イオンを銅にするためには、2分子の電子が必要です。つまり、銅イオンを銅にするには、銅イオンの分子数の2倍の電子数が必要、となります。
この理屈を理解してから、計算問題をファラデーの法則の文章を読みながら解いてみましょう。文章で理解するよりも、実際に数字を動かした方が、この法則は身につきます。
まずは、電子の受け渡しが重要です。それに伴って、電子の受け取りやすさ、渡しやすさがしっかりと判別できるようになることを意識して学習して下さい。
さらに、電気分解をしているときの物質量の変化がありますが、ここの計算問題は難しく思えるかもしれませんが、ファラデーの法則を理解すれば難しくありません。